ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ
, ур-ние состояния реального газа. Для
п молей газа, имеющего объем V при т-ре Т и давлении
р. имеет вид:
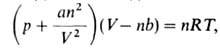
где R-газовая постоянная, а и b-постоянные Ван-дер-Ваальса,
характерные для данного в-ва. Член an2/V2 учитывает
притяжение молекул газа (уменьшение давления) вследствие межмолекулярных
взаимод., член nb-отталкивание молекул на близких расстояниях из-за наличия
у них "собственного объема". Для разреженных газов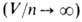 В. у. принимает вид: pV = nRT (см. Клапейрона-Менделеева уравнение
).
Постоянные а и b определяют экспериментально, напр. по
параметрам критич. точки.
В. у. принимает вид: pV = nRT (см. Клапейрона-Менделеева уравнение
).
Постоянные а и b определяют экспериментально, напр. по
параметрам критич. точки.
В. у. - простейшее ур-ние состояния, позволяющее определять точку фазового
перехода газ - жидкость и критич. т-ру, выше к-рой в-во может находиться
только в газообразном состоянии. Однако В. у. является приближенным и количественно
описывает нек-рые св-ва газа лишь при высоких Т и низких р. Оно
даже качественно не описывает многие св-ва реального газа, напр. зависимость
изохорной теплоемкости от плотности. Термодинамич. св-ва газов м. б. рассчитаны
с достаточной точностью на основе вириаль-ного уравнения состояния.
Ур-ние было предложено И. Д. Ван-дер-Ваальсом в 1873.
Лит. см. при ст. Газы
. М.А. Анисимов.

