ВИЛЬГЕРОДТА РЕАКЦИЯ
(р-ция Вильгеродта - Киндлера), превращение
алкиларилкетонов в амиды карбоновых к-т при действии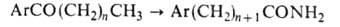 полисульфида аммония:
полисульфида аммония:
В. р. была распространена также на диалкилкетоны, альдегиды, тиокетоны,
производные альдегидов и кетонов (оксимы, имины и т.п.), олефины, ацетилены,
спирты, тиолы и др., напр.:
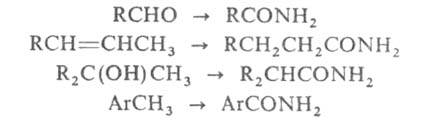
Обычно исходное соед. нагревают с водным р-ром желтого полисульфида
аммония при ~ 200 °С под давлением. Добавление орг. р-рителя (напр., диоксана,
пиридина) позволяет снизить т-ру р-ции до 150-160°С Амиды гидролизуют в
соответствующие карбоновые к-ты.
Широко используют модификацию Киндлера - получение тиоамидов нагреванием
исходного соед. со смесью S и амина (обычно морфолина) при 130-150°С:
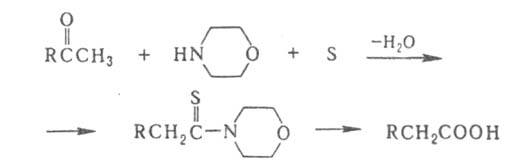
Выходы арилуксусных к-т из метиларилкетонов обычно составляют 50-80%;
удлинение алифатич. цепи и использование чисто алифатич. кетонов, как правило,
приводит к снижению выхода. Стирол и фенилацетилен образуют фенилацетамид
с выходами соотв. 64 и 80%.
Механизм В. р. окончательно не установлен. Сохранение углеродного скелета
доказано с помощью изотопной метки. Возможно, что перенос функц. группы
с середины цепи на ее конец связан с рядом последовательных р-ций отщепления
и присоединения сероводорода (р-ция 1) либо р-ций тиолирования, изомеризации
"дитиоацилоинов" и десульфуризации (2):
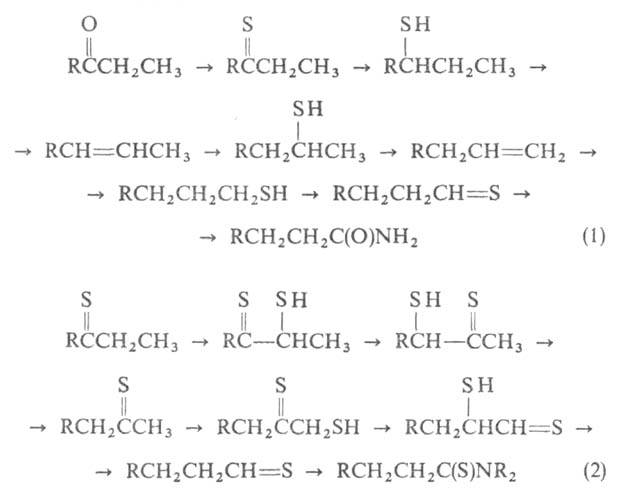
В. р. применяют для получения арилалифатич. карбоновых к-т из доступных
алкиларилкетонов, получаемых по р-ции Фриделя - Крафтса. Р-ция открыта
К. Вильгеродтом в 1887.
Лит.: Л эй рд Т., в кн.: Общая органическая химия, пер. с англ.,
т. 2, М., 1982, с. 795-97; Кулиев А.Б. [и др.]; "Ж. орг. химии", 1982,
т. 18, в. 8, с. 1709-11.

