ВОДОРОДНАЯ ЭНЕРГЕТИКА
, использует водород как носитель
энергии. В.э. также включает: получение Н2 из воды и др. прир.
сырья; хранение Н2 в газообразном и сжиженном состояниях или
в виде искусственно полученных хим. соед., напр. гидридов интерметаллич.
соединений; транспортирование Н2 к потребителю с небольшими
потерями. В. э. пока не получила массового применения. Методы получения
Н2, способы его хранения и транспортировки, к-рые рассматриваются
как перспективные для В. э., находятся на стадии опытных разработок и лаб.
исследований.
Выбор Н2 как энергоносителя обусловлен рядом преимуществ,
главные из к-рых: экологич. безопасность Н2, поскольку продуктом
его сгорания является вода, исключительно высокая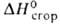 , равная - 143,06 МДж/кг (для условного углеводородного топлива — 29,3
МДж/кг); высокая теплопроводность, а также низкая вязкость, что очень важно
при его транспортировании по трубопроводам; практически неогранич. запасы
сырья, если в кач-ве исходного соед. для получения Н2 рассматривать
воду (содержание воды в гидросфере 1,39*1018т); возможность
многостороннего применения Н2. Водород м. б. использован как
топливо во многих хим. и металлургич. процессах, а также в авиации и автотранспорте
как самостоятельное топливо, так и в виде добавок к моторным топливам.
, равная - 143,06 МДж/кг (для условного углеводородного топлива — 29,3
МДж/кг); высокая теплопроводность, а также низкая вязкость, что очень важно
при его транспортировании по трубопроводам; практически неогранич. запасы
сырья, если в кач-ве исходного соед. для получения Н2 рассматривать
воду (содержание воды в гидросфере 1,39*1018т); возможность
многостороннего применения Н2. Водород м. б. использован как
топливо во многих хим. и металлургич. процессах, а также в авиации и автотранспорте
как самостоятельное топливо, так и в виде добавок к моторным топливам.
Перспективно использование Н2 для передачи энергии т. наз.
хим. способами. По одному из них смесь Н2 с СО, полученная на
первой ступени каталитич. конверсии метана, передается к потребителю по
трубопроводу и поступает в аппарат - метанатор, в к-ром осуществляется
обратная экзотермич. р-ция: ЗН2 + СО -> СН4 + Н2О.
Выделяемое тепло м. б. использовано для бытового и пром. теплоснабжения,
а паро-газовая смесь возвращается обратно в цикл для конверсии метана.
Традиц. способы получения Н2 (см. Водород
)для В.
э. экономически не выгодны. Для нужд В. э. предполагается усовершенствовать
традиц. методы и разработать новые, нетрадиционные, используя ядерную и
солнечную энергию. Предлагаемое усовершенствование осн. традиц. метода
получения Н2 - каталитич. конверсии прир. газа и газов нефтепереработки
- заключается в том, что процесс проводят в кипящем слое катализатора,
тепло подводят от высокотемпературного ядерного газоохлаждаемого реактора
(ВТГР). Применение этого метода позволит более чем в 10 раз увеличить объемную
скорость процесса, снизить т-ру в хим. реакторе на 150°С, уменьшить затраты
на произ-во Н2 на 20-25%. Однако ВТГР, обеспечивающие высокие
т-ры теплоносителя (ок. 1000°С), пока находятся в стадии разработок. Др.
вариант получения Н2 - водно-щелочной электролиз под давлением
с использованием дешевой разгрузочной электроэнергии, вырабатываемой в
ночное время атомной электростанцией. Расход электроэнергии на получение
1 м3 Н2 составляет 4,3-4,7 кВт*ч (по обычному способу
5,1-5,6 кВт*ч), напряжение на ячейке 1,7-2,0 В при плотности тока 3-5
кА/м2 и давлении в электролизере до 3 МПа. Использование установок
по получению Н2 в ночное время на атомных электростанциях позволит
регулировать график их суточной нагрузки и снизить себестоимость Н2.
Полученный Н2 может направляться на нужды промети либо использоваться
как топливо на электростанции для выработки дополнит. электроэнергии в
дневное время.
Ниже описаны предлагаемые нетрадиц. методы получения Н2.
Электролиз воды с использованием в кач-ве электролита расплава щелочи (т.
наз. расплавнощелочной электролиз), твердого полимера (твердополимерный,
или ТП-электролиз), керамики на основе ZrO2 (высокотемпературный,
или ВТ-электролиз) требует затрат электроэнергии на 30-40% меньше, чем
традиц. способ. При расплавнощелочном электролизе концентрация воды в электролите
составляет 0,5-2,0% по массе (иногда 4%), давление атмосферное, т-ра определяется
выбором щелочи. Использование твердых электролитов позволяет значительно
сократить расстояние между электродами в ячейке (до 250 мкм), в результате
чего в неск. раз повышается плотность тока без увеличения напряжения на
ячейке электролизера. В кач-ве электролита при ТП-электролизе можно использовать,
напр., пленку из сульфированного фторопласта-4; т-ра процесса до 150°С,
достижимый кпд электролизера 90%, расход электроэнергии на получение 1
м3 Н2 3,5 кВт*ч. наиб. перспективен ВТ-электролиз
с использованием тепла от ВТГР: электролитом служит керамика из ZrO2
с добавками оксидов металлов (преим. Y2O3, CaO, Sc2O3);
т-ра процесса 800-1000 °С, достижимый уровень расхода электроэнергии на
получение 1 м3 Н2 2,5 кВт*ч при плотностях тока 3-10
кА/м2.
Из плазмохим. методов получения Н2 наиб. перспективен двухстадийный
углекислотный цикл, включающий: 1) диссоциацию (2СО2 -> 2СО
+ О2), осуществляемую в плазмотроне с энергетич. эффективностью
до 75-80%; 2) конверсию СО с водяным паром (СО + Н2О -> Н2
+ СО2), после к-рой образовавшийся СО2 возвращается
в плазмотрон.
Термохим. циклы получения Н2 представляют собой совокупность
последоват. хим. р-ций, приводящих к разложению исходного водородсодержащего
сырья (обычно воды) при более низкой т-ре, чем та, к-рая требуется для
термич. диссоциации. Так, степень термич. диссоциации воды при 2483°С составляет
11,1%. В этих циклах все компоненты системы, кроме водородсодержащего сырья,
регенерируются. Ниже приводятся примеры термохим. циклов разложения воды.
Сернокислотный:

Представляют интерес также сероводородные термохим. циклы, напр.:
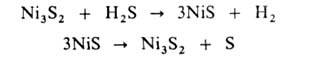
При использовании H2S вместо воды снижаются затраты энергии
на получение Н2, т.к. энергия связи Н—S в сероводороде значительно
меньше энергии связи Н—О в воде, и кроме Н2 образуется сера
- важное хим. сырье.
Перспективен радиолиз воды и водных р-ров СО2, H2SO4,
HC1, HBr, H2S, AgCl и др. под действием ядерного излучения (жесткого ,
нейтронного). наиб. мощные источники такого излучения - ядерные реакторы.
Для развития этого метода необходимо создать источники ядерного излучения
с высокой энергонапряженностью, разработать системы, способные поглощать
реагирующей средой более 50% энергии излучения и использовать ее с радиац.
выходом более 10 молекул Н2 на 100 эВ.
,
нейтронного). наиб. мощные источники такого излучения - ядерные реакторы.
Для развития этого метода необходимо создать источники ядерного излучения
с высокой энергонапряженностью, разработать системы, способные поглощать
реагирующей средой более 50% энергии излучения и использовать ее с радиац.
выходом более 10 молекул Н2 на 100 эВ.
Исследуются фотохим. методы получения Н2 с использованием
солнечной энергии. Осуществлен фотоэлектролиз воды (с раздельным получением
Н2 и О2); метод будет представлять практич. интерес,
если его кпд достигнет 10-12% (пока он составляет ок. 3%). Биофотолиз воды
основан на том, что нек-рые микроорганизмы (напр., хлорелла), поглощающие
солнечную энергию, способны разлагать воду. Средний кпд трансформации солнечной
энергии такими микроорганизмами составляет ок. 8%.
Для хранения и транспортирования Н2, кроме обычных методов,
разработанных для жидкого и газообразного водорода, перспективно использование
твердых соед. - гидридов металлов и интерметаллидов. Последние способны
реагировать с большими кол-вами Н2 при невысоких т-рах и давлениях
(см. Гидриды
). Из гидридов интерметаллидов наиб. интересны соед.
на основе Ti, Fe, Mg, Ni, La и V. Они содержат до 400 см3 Н2
на 1 г гидрида, выделяют Н2 при сравнительно низких т-рах (150-200
°С) и относительно дешевы. Для хранения гидридов интерметаллидов разработаны
спец. емкости - гидридные баки. Гидриды интерметаллидов м. б. использованы,
в частности, на автотранспорте. Гидридный бак устанавливается на автомобиле
и обогревается отработавшими газами двигателя: гидрид разлагается и выделяется
водород, к-рый подается в двигатель как добавка к бензину.
Лит.: Легасов В. А. [и дрЛ, в кн.: Атомно-во дородная энергетика
и технология, в. 1, М., 1978, с. 11-36; Березин И. В. [и др.], там же,
в. 2, М., 1979, с. 48-56; Мищенко А. И., Применение водорода для автомобильных
двигателей, К., 1984; Шпильрайн Э. Э., Малышенко С. П., Кулешов Г. Г.,
Введение в водородную энергетику, под ред. В.А. Легасова, М. (в печати);
McAul-iffe Ch. A., Hydrogen and energy, Ц., 1980. В.А.Легасов.

