ЭЛЕКТРОННЫЕ СПЕКТРЫ
, мол. спектры,
обусловленные квантовыми переходами из одного электронного состояния молекулы
в другое. Переходы, при к-рых происходит поглощение кванта электромагн.
излучения, образуют Э. с. поглощения. Переходы, сопровождающиеся испусканием
излучения, образуют Э. с. испускания. Э. с. расположены, как правило, в
видимой и УФ областях спектра, они являются ценным источником сведений
о строении молекул и межмол. взаимодействиях.
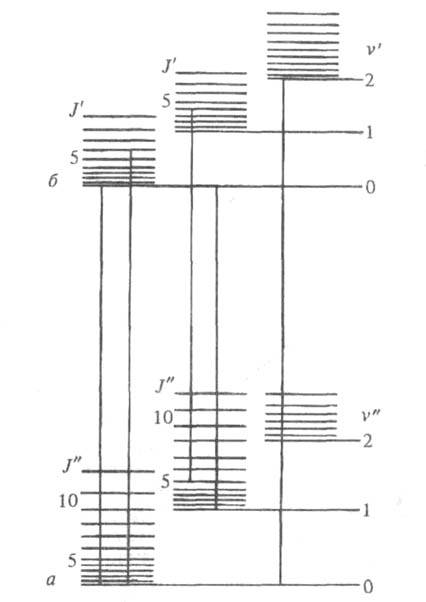
Рис. 1. Схема уровней энергии двухатомной
молекулы: а и б - электронные уровни; v и v"
- квантовые числа колебат. уровней; J и J" - квантовые числа
вращат. уровней.
Существование у каждого из электронных
состояний молекулы колебат. и вращат. уровней энергии приводит к тому,
что электронный переход в Э. с. оказывается представленным не одной линией
(как в случае атомов), а сложной системой линий, принадлежащих разным электронно-колебательно-вращат.
переходам (рис. 1). Волновое число линии
v такого спектра описывается
выражением
v = vэл + vкол
+ vвр
Величина vэлпредставляет
собой разность электронных энергий молекулы в минимумах поверхности потенц.
энергии молекулы vкол и vвр - разности
энергий соотв. для колебат. и вращат. уровней.
Классификация электронных состояний
молекулы
основывается на ряде признаков, из к-рых, прежде всего, следует отметить
мулътиплетностъ и тип симметрии. Мультиплетность электронного состояния
М задается квантовым числом S результирующего электронного
спина (М = 2S+ 1) и характеризует кратность вырождения состояния
по спину. Состояние с М = 1 (S = 0) наз. синглетным (обозначается
буквой S), состояние с М=2 (S = 1/2)
- дублетным (D), состояния с М=3 - триплетным (Т)и
т.д. В магн. поле вырождение, состояний снимается: дублетное состояние
расщепляется на два подуровня, триплетное - на три подуровня (см. Вырождение энергетических уровней
). Электронное состояние с наименьшей энергией
наз. основным (как правило, 50-состояние), остальные состояния
- возбужденные (S1, S2, T1,
T2 ...). У большинства известных молекул в своб.
состоянии основное состояние является синглетным. Молекулы с нечетным числом
электронов, к числу к-рых относится, напр., NO, имеют обычно дублетное
основное состояние. Среди молекул, имеющих в качестве основного триплетное
состояние, прежде всего выделяют мол. кислород О2.
Возбужденные состояния молекул, образовавшиеся
в результате поглощения кванта света, как правило, быстро теряют энергию
возбуждения (дезактивируются), причем механизмы дезактивации м. б. различными.
Время жизни низших возбужденных
S1-состояний колеблется
для разных молекул между 10-10 и 10-7 с, для T1
состояний от 0,0001 с до неск. секунд. Лежащие более высоко по энергии
возбужденные состояния часто дезактивируются безызлучательно и имеют времена
жизни менее 10-11 с.
Электронные состояния двухатомных и линейных
многоатомных молекул классифицируют также по величине проекции их результирующего
орбитального (углового) момента ML на ось молекулы. Состояния
с разл. ML , принято обозначать буквами греч. алфавита (ML
= 0), П (ML = 1),
(ML
= 0), П (ML = 1), (ML
= 2) и т. д. Такая классификация, по существу, определяется осевой
симметрией линейных молекул.
(ML
= 2) и т. д. Такая классификация, по существу, определяется осевой
симметрией линейных молекул.
Классификация состояний нелинейных молекул
также проводится часто по симметрии ядерной подсистемы (перестановочной
симметрии для тождественных ядер и точечной симметрии, напр. для их равновесных
конфигураций; см. Симметрия молекул
). Наличие точечной группы симметрии
позволяет установить характер преобразований волновых ф-ций при операциях
симметрии. Так, если молекула обладает центром симметрии, волновые ф-ции
одних электронных состояний сохраняют свой вид при операциях инверсии,
тогда как волновые ф-ции других состояний при этом меняют знак. В первом
случае говорят о четном состоянии, к-рое обозначают нижним индексом "g",
во втором - о нечетном состоянии (индекс "и").
Отыскание волновых ф-ций, описывающих
электронные состояния молекулы, производится с помощью методов квантовой
химии (см., напр., Молекулярных орбиталей методы
). Часто волновая
ф-ция строится в одноэлектронном приближении, когда мол. орбитали (МО)
записываются в виде линейной комбинации атомных орбиталей (см. ЛКАО-приближение
).
При
качеств. рассмотрении электронно-возбужденных состояний часто ограничиваются
учетом их симметрии и указанием того, как меняются МО исходного электронного
состояния при возбуждении (при переходе в конечное состояние). При т. наз.
одноэлектронном переходе электрон одной из орбиталей, напр. или
или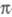 -орбитали
либо п-орбитали неподеленной пары электронов, меняет свое состояние,
переходит на вакантную орбиталь (обозначается звездочкой:
-орбитали
либо п-орбитали неподеленной пары электронов, меняет свое состояние,
переходит на вакантную орбиталь (обозначается звездочкой: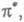
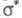 либо
либо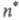 ).
В зависимости от того, с какой занятой орбитали на какую вакантную орбиталь
переходит электрон, возникают переходы типа
).
В зависимости от того, с какой занятой орбитали на какую вакантную орбиталь
переходит электрон, возникают переходы типа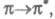
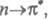
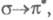
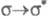 и т. п.
и т. п.
Правила отбора. В Э. с. проявляются
далеко не все энергетически возможные для молекулы переходы. В случае одноэлектронных
возбуждений разрешенными, т. е. имеющими отличную от нуля интенсивность
линии в Э. с., являются переходы между состояниями одинаковой мультиплетности,
напр. между синглетными состояниями (S S)или
между триплетными состояниями (Т
S)или
между триплетными состояниями (Т Т),
тогда
как интеркомбинационные переходы типа S
Т),
тогда
как интеркомбинационные переходы типа S Т запрещены.
Имеются запреты и по типам симметрии волновых ф-ций состояний.
Т запрещены.
Имеются запреты и по типам симметрии волновых ф-ций состояний.
Интенсивность полосы в Э. с. определяется
прежде всего вероятностью перехода между электронными состояниями, к-рая,
в свою очередь, связана с дипольным моментом перехода Р:
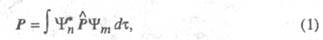
где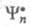 и
и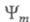 - волновые
ф-ции исходного и конечного состояний;
- волновые
ф-ции исходного и конечного состояний;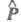 -
оператор дипольного момента (см. Квантовые переходы
). Интеграл берется
по пространств. координатам и спиновым переменным всех электронов и ядер
(
-
оператор дипольного момента (см. Квантовые переходы
). Интеграл берется
по пространств. координатам и спиновым переменным всех электронов и ядер
(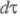 - элемент
пространства всех этих переменных). Волновую ф-цию
- элемент
пространства всех этих переменных). Волновую ф-цию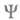 в грубом приближении Борна-Оппенгеймера (см. Адиабатическое приближение
)представляют
в виде произведения ф-ций
в грубом приближении Борна-Оппенгеймера (см. Адиабатическое приближение
)представляют
в виде произведения ф-ций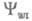 (зависит от координат электронов) и
(зависит от координат электронов) и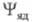 (зависит от координат ядер). Тогда выражение (1) принимает вид:
(зависит от координат ядер). Тогда выражение (1) принимает вид:
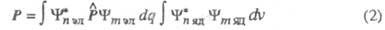
(dq и dv - элементы пространства
соотв. электронных и ядерных переменных). Величина Р не равна нулю,
если не равен нулю ни один из интегралов в выражении (2). Т. к. оператор
дипольного момента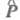 не зависит от спиновых переменных, первый интеграл, вообще говоря, не равен
нулю, в частности, если состояния имеют одинаковую мультиплетность. Интеркомбинационные
переходы между состояниями разной мультиплетности, хотя и наблюдаются в
действительности, имеют очень малую вероятность. Причиной нарушения интеркомбинационного
запрета служит спин-орбитальное взаимодействие
, оно учитывается
методами возмущений теории
.
не зависит от спиновых переменных, первый интеграл, вообще говоря, не равен
нулю, в частности, если состояния имеют одинаковую мультиплетность. Интеркомбинационные
переходы между состояниями разной мультиплетности, хотя и наблюдаются в
действительности, имеют очень малую вероятность. Причиной нарушения интеркомбинационного
запрета служит спин-орбитальное взаимодействие
, оно учитывается
методами возмущений теории
.
Второй интеграл означает, что в колебат.
структуре разрешенного по симметрии электронного перехода будут активны
только те колебания, для к-рых подынтегральная ф-ция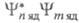 является полносимметричной или содержит полносимметричную составляющую.
Запреты по симметрии нарушаются из-за электронно-колебательного взаимодействия
.
является полносимметричной или содержит полносимметричную составляющую.
Запреты по симметрии нарушаются из-за электронно-колебательного взаимодействия
.
Колебательная структура Э. с. Энергетич.
интервалы между колебат. уровнями энергии одного и того же электронного
состояния молекулы существенно больше, чем между вращат. уровнями. Поэтому
колебат. структуру Э. с. принято называть грубой структурой. Каждый электронно-колебат.
переход представлен в спектре системой линий, связанных с переходами между
разными вращат. уровнями (Тонкая структура). Эта система линий регистрируется
на приборах с высоким разрешением. Для сравнительно простых молекул, находящихся
в газообразном состоянии, Э. с., полученные на приборах с малым или средним
разрешением, состоят из колебательно-вращат. полос (полосатые спектры).
Э. с. многоатомных молекул обычно получают
для конден-сир. фазы (жидкие и твердые р-ры, кристаллы). Эти спектры, как
правило, имеют вид широких бесструктурных или слабо структурированных полос.
Лишь при низких т-рах (обычно 77 К, 20 К или 4,2 К) в матрицах из замороженных
н-парафинов
(матрицы Шпольского) полосы распадаются на большое число линий или узких
полос (квазилиний), отражающих колебат. структуру каждого из электронных
переходов. В отличие от обычных широкополосных Э. с. такие квазилинейчатые
Э. с. являются для молекул характеристичными. Для молекул в др. средах
при низких т-рах удается получить тонкоструктурный спектр флуоресценции,
если возбуждать молекулы лазером с длиной волны возбуждения, приходящейся
на область чисто электронного перехода (см. Лазерная спектроскопия
).
Спектры поглощения. У подавляющего
числа известных многоатомных молекул Э. с. поглощения определяются переходами
из основного синглетного состояния S0 в возбужденные
синглетные состояния Si (т. наз. S0 Si-спектры).
При комнатной и более низких т-рах почти все молекулы находятся на нулевом
колебат. уровне. Полосы поглощения обусловлены переходами с нулевого колебат.
уровня S0-состояния на разл. колебательные уровни Si-состояний
(рис. 2). Ввиду того, что возбужденные состояния быстро дезактивируются,
в Э. с. поглощения обычно не наблюдаются полосы, связанные с переходами
S1
Si-спектры).
При комнатной и более низких т-рах почти все молекулы находятся на нулевом
колебат. уровне. Полосы поглощения обусловлены переходами с нулевого колебат.
уровня S0-состояния на разл. колебательные уровни Si-состояний
(рис. 2). Ввиду того, что возбужденные состояния быстро дезактивируются,
в Э. с. поглощения обычно не наблюдаются полосы, связанные с переходами
S1 Si
или T1
Si
или T1 Тi.
Их удается зарегистрировать Лишь с помощью импульсных ламп или лазеров,
позволяющих создать на короткое время заметную заселенность T1-
и S1-состояний. Получаемые при этом спектры T1
Тi.
Их удается зарегистрировать Лишь с помощью импульсных ламп или лазеров,
позволяющих создать на короткое время заметную заселенность T1-
и S1-состояний. Получаемые при этом спектры T1 Ti- и
S1
Ti- и
S1 Si -поглощения
наз. спектрами наведенного поглощения.
Si -поглощения
наз. спектрами наведенного поглощения.
Поглощение света отдельно взятой молекулой
- анизотропный процесс. Дихроизм поглощения для кристаллов, ориентированных
пленок, жидких кристаллов принято характеризовать величиной
d:
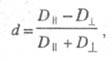
где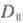 и
и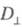 - оптич.
плотности для линейно поляризованного света определенной длины волны с
плоскостью поляризации, соотв. параллельной и перпендикулярной выделенному
в в-ве направлению, напр. оси ориентации (растяжения) пленки. Зависимость
- оптич.
плотности для линейно поляризованного света определенной длины волны с
плоскостью поляризации, соотв. параллельной и перпендикулярной выделенному
в в-ве направлению, напр. оси ориентации (растяжения) пленки. Зависимость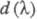 наз. спектрами дихроизма.
наз. спектрами дихроизма.
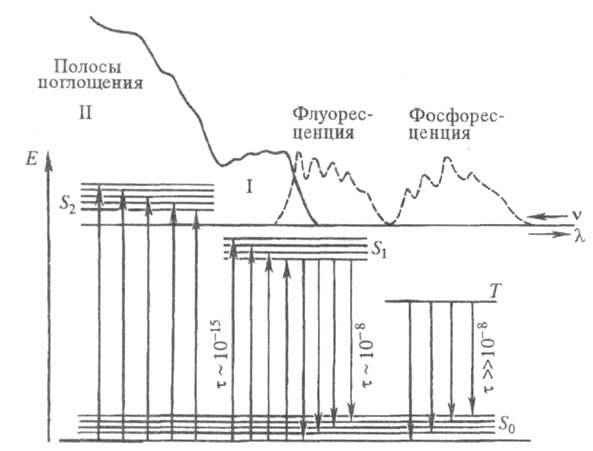
Рис. 2. Электронные спектры испускания
(I) и поглощения (II). Указаны времена жизни (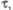 с) и типы (S0, S1, S2, T1)
энергетач. состояний. Е -
энергия;
с) и типы (S0, S1, S2, T1)
энергетач. состояний. Е -
энергия;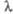 - длины волн; v - волновые числа линий поглощения или испускания.
- длины волн; v - волновые числа линий поглощения или испускания.
Весьма часто в многоатомных молекулах можно
выделить сравнительно небольшие фрагменты, наз. хромофорными группами (хромофорами),
к-рые в осн. ответственны за поглощение излучения. Электронное возбуждение
при этом определяется гл. обр. изменением электронного распределения именно
в локальных областях этих групп.
Поглощение света в-вом характеризуют обычно
пропусканием, равным отношению интенсивностей прошедшего и падающего пучков,
либо коэф. экстинкции, связанным с логарифмом пропускания (см. Абсорбционная спектроскопия
). Полосам поглощения в Э. с. соответствуют молярные коэф.
экстинкции от 103 до 106, тогда как в случае, напр.,
запрещенных по симметрии электронных переходов эти коэф. обычно не превышают
10 - 102.
Спектры испускания. Многоатомные
молекулы в конденсир. фазе способны заметно испускать свет лишь при переходах
из S1 - и T1 состояний. Испускание,
связанное с излучат. переходом S1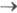 S0,
получило назв. флуоресценции, а связанное с переходом T1
S0,
получило назв. флуоресценции, а связанное с переходом T1 S0
- фосфоресценции (см. Люминесценция
). Возбужденные молекулы
до акта испускания света успевают частично дезактивироваться и оказываются
на нулевом колебат. уровне S1 или T1
состояния.
S0
- фосфоресценции (см. Люминесценция
). Возбужденные молекулы
до акта испускания света успевают частично дезактивироваться и оказываются
на нулевом колебат. уровне S1 или T1
состояния.
При возбуждении в-ва линейно поляризованным
светом испускание оказывается анизотропным. Степенью поляризации излучения
наз. величину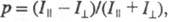 где
где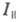 интенсивность
той компоненты излучения, к-рая поляризована так же, как и возбуждающий
свет, а
интенсивность
той компоненты излучения, к-рая поляризована так же, как и возбуждающий
свет, а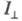 -
интенсивность перпендикулярно поляризованной этому направлению компоненты.
Степень поляризации излучения каждого в-ва в р-ре зависит, в частности,
от природы р-рителя и от длины волны возбуждающего света.
-
интенсивность перпендикулярно поляризованной этому направлению компоненты.
Степень поляризации излучения каждого в-ва в р-ре зависит, в частности,
от природы р-рителя и от длины волны возбуждающего света.
Применение Э. с. По интенсивности
полос Э. с. можно судить о концентрации данного в-ва в р-ре (см. Спектрофотометрия
).
Так,
по спектрам поглощения удается зарегистрировать следы в-ва до 10-4-10-6
моль/л, тогда как при анализе смесей с использованием замороженных матриц
Шпольского можно подчас определить неск. индивидуальных компонентов смеси
с абс. чувствительностью до 10-11 г (концентрация в-ва в таких
матрицах обычно составляет 10-5-10-6 моль/л). На
основе квазилинейчатых спектров люминесценции разработан высокочувствит.
и селективный мол. спектральный анализ
сложных орг. смесей. По изменению
интенсивности отд. полос судят об увеличении или уменьшении кол-ва отд.
компонентов смеси при изменении условий (напр., рН среды), о наличии в
системе тех или иных хромофорных групп и их взаимод., величине дипольного
момента молекул, симметрии молекул и др. Э. с., получаемые при низких т-рах
в матрицах, позволяют судить о "замороженных" свободных радикалах и их
превращениях, а при разрешенной колебат. структуре дают возможность определять
спектроскопич. постоянные, напр. фундам. частоты колебаний для разл. электронных
состояний.
Для этих же целей широко используют и
Э. с. молекул в газовой фазе, хотя детальная информация м. б. получена
в осн. лишь для малоатомных молекул. Для получения информативных электронно-колебат.
спектров паров многоатомных молекул разработан спец. метод, основанный
на охлаждении в-ва в сверхзвуковой струе инертного газа. Совр. методы анализа
электронно-колебат. спектров позволяют получать сведения о тонких эффектах
спин-орбитальных, электронно-колебат. и электрон-фононных взаимод. в возбужденных
электронных состояниях молекулы, об орбитальной природе этих состояний.
Для получения Э. с. используют разл. комбинации
методов, напр. возбуждение молекул световыми импульсами малой длительности,
в т.ч. пико- и фемтосекундными с послед. зондированием образовавшихся возбужденных
состояний излучением другой частоты. Подобные методы позволяют следить
за эволюцией мол. систем во времени, в частности при хим. превращениях.
Поскольку Э. с. молекул зависят от условий
их получения (фазовое состояние в-ва, т-ра образца, рН среды и др.), они
применяются для исследований межмолекулярных взаимодействий
и их
связи с внеш. условиями, особенно в тех случаях, когда эти взаимод. велики
(напр., при образовании водородных связей).
Лит.: Ельяшевич М. А., Атомная и
молекулярная спектроскопия, М., 1962; Герцберг Г., Электронные спектры
и строение многоатомных молекул, пер. с англ., М., 1969; Свердлова О.В.,
Электронные спектры в органической химии, 2 изд., Л., 1985.
Р. H. Нурмухаметов.

