АНТИМОНИДЫ
(стибниды), соед. сурьмы с металлами. Кристаллич.
в-ва с металлич. блеском, обычно серебристо-белого или серого цвета, с
относительно высокими т-рами плавления. Обладают металлич. или полупроводниковой
проводимостью; нек-рые А. при низких т-рах-сверхпроводники. Щелочные металлы
образуют А. состава M3Sb, MSb и, начиная с К, MSb2
и др. Число образуемых А. увеличивается от Li к Cs. Для соед. M3Sb
характерна гексаген. Кристаллич. решетка типа Na3As, для MSb-моноклинная
типа LiAs, для MSb2-моноклинная типа MgCu2. А. щелочных
металлов - полупроводники с шириной запрещенной зоны 1,0-1,5 эВ. Медь и
серебро образуют по неск. бер-толлидных фаз; для Си известен также Cu2Sb.
Получены только высшие антимониды Au-AuSb2 и AuSb3.
Для элементов II группы характерно образование M3Sb2.
Для Be и Mg известны А. только такого состава; другие щел.-зем. металлы
дают ряд А., в т.ч. MSb и MSb3, причем число соед. увеличивается
от Са к Ва. Цинк и кадмий образуют А. составов M3Sb2,
MSb и M3Sb4, ртуть-Hg3Sb2.
Металлы подгруппы Ilia образуют А. состава MSb, имеющие наиб. практич.
значение. Все они, кроме металло-подобного TISb, кристаллизуются в кубич.
решетке типа сфалерита и являются полупроводниками. С ростом атомного номера
металла увеличиваются межатомные расстояния в молекулах, понижаются т-ры
плавления, ширина запрещенной зоны и энергия диссоциации, уменьшается твердость
и повышается плотность соединений. Элементы подгруппы III6, включая лантаноиды
и актиноиды, образуют ряд А., из к-рых наиб. характерны: MSb (со структурой
типа NaCl), M2Sb (с тетрагон, кристаллич. решеткой), M4Sb3,
MSb2 (с моноклинной или тетрагон, решеткой), M5Sb3
(с гексагон. решеткой типа Mn5Si3).
Из элементов подгруппы IVa только для Sn известен SnSb (с кубич. кристаллич.
решеткой). Переходные металлы IV-VIII групп образуют разнообразные А.,
из к-рых чаще других встречаются MSb, MSb2, MSb3,
M2Sb, M3Sb. Число соед. при переходе от IV группы
к VI уменьшается, а далее, начиная с подгруппы Со, снова увеличивается.
При переходе от четвертого к шестому периоду наблюдается тенденция к уменьшению
числа А. наиб. число А. у Ni (6), V и Rh (по 5). Для Сг, Mn, Fe, Ru известно
по два А., для Mo, W и Os - пo одному (Mo3Sb7, WSb
и OsSb2). Большинство соед. состава MSb имеет гексагон. кристаллич.
решетку типа NiAs или ромбическую типа МпР. Для MSb2 характерна
структура типа пирита или марказита. Соед. M2Sb кристаллизуются
обычно в тетрагон. решетке типа Cu2Sb. Элементы подгруппы Со
образуют А. состава MSb3 с кубич. кристаллич. решеткой типа
CoAs3, элементы подгруппы Ti и V - соед. M3Sb с кубич.
решеткой типа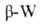 или Cr3Si.
или Cr3Si.
Большинство А. переходных элементов металлоподобны, нек-рые соед. MSb2
и особенно MSb3 - полупроводники, причем с увеличением атомной
массы металла в пределах группы ширина запрещенной зоны возрастает. Нек-рые
А. при низких т-рах становятся сверхпроводниками, наиб. высокие т-ры перехода
у Nb5Sb4 (8,60 К), Ti3Sb (5,80 К). Нек-рые
А. - антиферромагнетики с относительно высокими точками Нееля: 723 К для
CrSb, 213 К для USb. Другие, напр. MnSb, MnSb2, - ферромагнетики,
для к-рых характерны анизотропия магн. св-в и изменение с т-рой направления
наиб. магн. восприимчивости.
Известен ряд двойных А., напр.: LiCdSb, K2CuSb2,
BaZn2Sb2, TiSnSb, ZnSnSb2, NbSnSb. По
св-вам близки к А. антимонохалькогениды MSbX, где X = S, Se, Те. Эти соед.
металлоподобны или полупроводники, при низких т-рах нек-рые из них становятся
сверхпроводниками.
А. щелочных и в неск. меньшей степени щел.-зем. металлов химически очень
активны, легко окисляются, гидроли-зуются водой с выделением SbH3.
Антимониды Mg и А1 менее активны, но легко разлагаются разб. к-тами. Все
остальные А. взаимод. только с конц. к-тами или царской водкой. С увеличением
содержания Sb в А. их хим. устойчивость повышается. Нек-рые А., в частности
образуемые щелочными металлами, раств. в солевых расплавах, напр. в смесях
LiCl-LiF или NaCl-Nal.
Известно ок. 15 сравнительно редких минералов, относящихся к А., напр.
дискразит Ag3Sb, брейтгауптит NiSb, уль-манит NiSbS.
А. синтезируют гл. обр. сплавлением компонентов в вакууме или в инертной
атмосфере, иногда под слоем флюса (напр., из NaCl, KC1, СаС12,
ВаС12). Мелкие кристаллы и пленки получают из газовой фазы -
сублимацией компонентов или путем хим. транспортных р-ций. Монокристаллы
выращивают методами направленной кристаллизации, вытягивания из расплава,
горизонтальной зонной плавки. Эпитаксиальные пленки получают вакуумным
напылением, осаждением из жидкой и газовой фаз. Нек-рые А. (напр., SnSb,
Cu2Sb) образуются в сплавах (баббитах, сурьмяных бронзах и др.).
Осн. область применения А. - полупроводниковая техника.
СВОЙСТВА АНТИМОНИДОВ
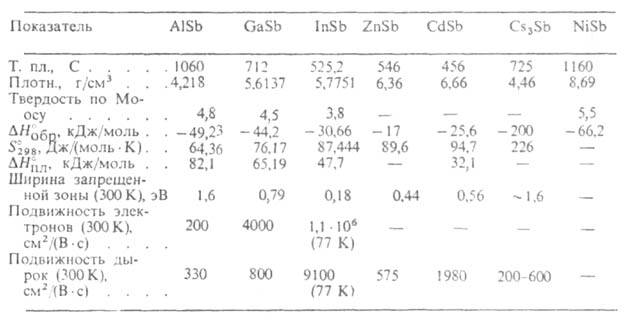
Св-ва важнейших А. приведены в таблице. Антимонид алюминия AlSb-темно-серые
с синеватым отливом кристаллы с металлич. блеском, решетка кубическая (а = = 0,61355 нм); перспективный материал для солнечных батарей и электронных
приборов, работающих при т-рах до ~500°С. Антимонид цинка ZnSb - серые
кристаллы с металлич. блеском, решетка ромбическая (а= 0,6128 нм, b = 0,7741
нм, с = 0,8115 нм, пространств. группа Рbса); материал для
термоэлектрич. приборов. Антимонид цезия Cs2Sb - черные кристаллы
с металлич. блеском, решетка кубическая (а = 0,9180 нм); используется
для изготовления фотоэмиттеров с высоким квантовым выходом. Антимониды
Cd и Mg, а также тройные соед. типа ZnSnSb2 - перспективные
полупроводниковые материалы; Th3Sb4 может использоваться
в кач-ве высокотемпературного термоэлектрич. материала; NiSb, как и др.
А. с металлич. проводимостью (CrSb, CoSb), предложено использовать как
компоненты эвтектич. композиций с InSb и GaSb для магнитосопротивлений,
детекторов ИК-излучения и др.
Осн. опасность при работе с А. представляет SbH3, выделяющийся
при действии воды или к-т на А. См. также Галлия антимонид
, Индия антимонид
.
Лит.: Самсонов Г.В., Абдусалямова М.Н., Антимониды, Душ.. 1977.
П. И. Федоров, Р.Х. Акчурин.

