АНТРАХИНОНСУЛЬФОКИСЛОТЫ
. Наиб. практич. значение имеют моносульфокислоты
ф-лы I-1-сульфокислота (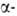 сульфокислота,
1-А.) и 2-сульфокислота (
сульфокислота,
1-А.) и 2-сульфокислота (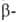 сульфокислота,
2-А.), а также 1,5- и 1,8-дисульфокислоты (1,5-А. и 1,8-А.)-светло-желтые
кристаллы (см. табл.); не раств. в неполярных орг. р-рителях, умеренно
раств. в спирте. А.-сильные к-ты; при взаимод. с SOC12, POC13,
РС15 образуют сульфохлориды; при нагр. с разб. H2SO4
десульфируются, причем
сульфокислота,
2-А.), а также 1,5- и 1,8-дисульфокислоты (1,5-А. и 1,8-А.)-светло-желтые
кристаллы (см. табл.); не раств. в неполярных орг. р-рителях, умеренно
раств. в спирте. А.-сильные к-ты; при взаимод. с SOC12, POC13,
РС15 образуют сульфохлориды; при нагр. с разб. H2SO4
десульфируются, причем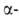 сульфокислоты
легче, чем
сульфокислоты
легче, чем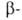 сульфокислоты;
восстанавливаются Zn в водном NH3 до сульфокислот антрацена,
а при действии Na2S2O4 в водно-щелочном
р-ре - до сульфокислот 9,10-антрагидрохинона. При нитровании или сульфировании
1-А. и 2-А. нитро- или сульфогруппа вступает в незамещенное ядро антрахинона.
Напр., из 1-А. образуются смеси 1-нитроантрахинон-5- и 1-нитроантрахинон-8-сульфокислот,
из 2-А. - 1-нитроантрахинон-6- и 1-нитроантрахинон-7-сульфокислот. Сульфогруппа
в А. обменивается на амино-, гидрокси-, алкил(арил)гидроксигруппы, атом
хлора, причем в случае
сульфокислоты;
восстанавливаются Zn в водном NH3 до сульфокислот антрацена,
а при действии Na2S2O4 в водно-щелочном
р-ре - до сульфокислот 9,10-антрагидрохинона. При нитровании или сульфировании
1-А. и 2-А. нитро- или сульфогруппа вступает в незамещенное ядро антрахинона.
Напр., из 1-А. образуются смеси 1-нитроантрахинон-5- и 1-нитроантрахинон-8-сульфокислот,
из 2-А. - 1-нитроантрахинон-6- и 1-нитроантрахинон-7-сульфокислот. Сульфогруппа
в А. обменивается на амино-, гидрокси-, алкил(арил)гидроксигруппы, атом
хлора, причем в случае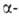 сульфокислот
легче, чем в случае
сульфокислот
легче, чем в случае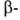 сульфокислот.
Так, 1-А. с Са(ОН)2 под давлением образует 1-гидроксиантрахинон,
с конц. водным р-ром NH3 при 160-180°С-1-аминоантрахинон, являющийся
промежут. продуктом в синтезе антрахиноновых кислотных и кубовых красителей;
при кипячении в водном солянокислом р-ре с КС1О3 или при пропускании
газообразного С12 в солянокислый р-р с добавлением NH4C1
A. образуют соотв. хлор- или дихлорантрахиноны - промежут. продукты в произ-ве
кубовых красителей.
сульфокислот.
Так, 1-А. с Са(ОН)2 под давлением образует 1-гидроксиантрахинон,
с конц. водным р-ром NH3 при 160-180°С-1-аминоантрахинон, являющийся
промежут. продуктом в синтезе антрахиноновых кислотных и кубовых красителей;
при кипячении в водном солянокислом р-ре с КС1О3 или при пропускании
газообразного С12 в солянокислый р-р с добавлением NH4C1
A. образуют соотв. хлор- или дихлорантрахиноны - промежут. продукты в произ-ве
кубовых красителей.
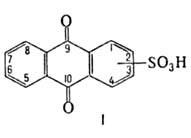
СВОЙСТВА АНТРАХИНОНСУЛЬФОКИСЛОТ
|
Положение сульфо-группы в ядре антрахинона
|
Мол. м.
|
Т. п. ч., оС
|
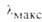
, им |
Р-римость К - соли в воде, г в 100 мл
|
|
1
|
288,27
|
218
|
332
|
1
|
|
2
|
288^7
|
|
328
|
0,9
|
|
1,5
|
368,24
|
311 (с разл.)
|
325
|
0,7
|
|
1,8
|
368,24
|
294 (с разл.)
|
330
|
18
|
2-А. в водно-щелочном р-ре при 185°С в присут. NaNO3 образует
ализарин, 1-А. при хлорировании в олеуме газообразным хлором образует 5,8-дихлорантрахинон-1-сульфокислоту
- промежут. продукт для получения 1,5,8-трихлорантрахинона, применяемого
в синтезе кубовых красителей.
В пром-сти А. получают сульфированием антрахинона в 20-40%-ном олеуме
при 100-150°С, причем без катализатора сульфогруппа вступает в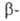 положение,
а в присут. сульфата Нg(П) - в
положение,
а в присут. сульфата Нg(П) - в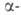 положение.
Из-за малого различия в скоростях вступления первой и второй сульфогрупп
в ядро процесс ведут так, чтобы при получении моносульфокислот в р-цию
вступало не более 50-70% антрахинона. После проведения р-ции массу разбавляют
водой, отфильтровывают непрореагировавший антрахинон, а из фильтрата, добавляя
КС1 или NaCl, выделяют 1-А. в виде К-соли или 2-А. в виде Na-соли ("серебристая
соль"). При получении 1,5-А. и 1,8-А. сульфирование в присут. соединений
Hg(II) проводят при более высокой т-ре или удлиняют время р-ции; изомерные
сульфокислоты разделяют дробной кристаллизацией: 1,5-А.-в виде динатриевой,
1,8-А. - в виде дикалиевой соли. Использование соединений Hg(II) осложняет
обезвреживание отходов произ-ва 1-А., 1,5-А. и 1,8-А. Др. способ синтеза
А.-сульфирование антрацена с послед. разделением изомерных сульфокислот
и окислением.
положение.
Из-за малого различия в скоростях вступления первой и второй сульфогрупп
в ядро процесс ведут так, чтобы при получении моносульфокислот в р-цию
вступало не более 50-70% антрахинона. После проведения р-ции массу разбавляют
водой, отфильтровывают непрореагировавший антрахинон, а из фильтрата, добавляя
КС1 или NaCl, выделяют 1-А. в виде К-соли или 2-А. в виде Na-соли ("серебристая
соль"). При получении 1,5-А. и 1,8-А. сульфирование в присут. соединений
Hg(II) проводят при более высокой т-ре или удлиняют время р-ции; изомерные
сульфокислоты разделяют дробной кристаллизацией: 1,5-А.-в виде динатриевой,
1,8-А. - в виде дикалиевой соли. Использование соединений Hg(II) осложняет
обезвреживание отходов произ-ва 1-А., 1,5-А. и 1,8-А. Др. способ синтеза
А.-сульфирование антрацена с послед. разделением изомерных сульфокислот
и окислением.
1,5-А. и 1,8-А.-промежут. продукты в произ-ве соответствующих дигидроксиантрахинонов;
их используют для получения 1,5- и 1,8-дихлорантрахинонов-исходных продуктов
для синтеза триантримидов и кубовых красителей на их основе. 2-А. и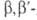 дисульфокислоты
антрахинона - катализаторы окислит.-восстановит. процессов; препятствуют
образованию вуали в фотографии.
дисульфокислоты
антрахинона - катализаторы окислит.-восстановит. процессов; препятствуют
образованию вуали в фотографии.
Лит.: Ворожцов Н. Н., Основы синтеза промежуточных продуктов
и красителей, 4 изд, М., 1955; Горелик М. В., Химия антрахинонов и их производных,
М.. 1983. С. И. Попов.



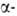 сульфокислота,
1-А.) и 2-сульфокислота (
сульфокислота,
1-А.) и 2-сульфокислота (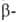 сульфокислота,
2-А.), а также 1,5- и 1,8-дисульфокислоты (1,5-А. и 1,8-А.)-светло-желтые
кристаллы (см. табл.); не раств. в неполярных орг. р-рителях, умеренно
раств. в спирте. А.-сильные к-ты; при взаимод. с SOC12, POC13,
РС15 образуют сульфохлориды; при нагр. с разб. H2SO4
десульфируются, причем
сульфокислота,
2-А.), а также 1,5- и 1,8-дисульфокислоты (1,5-А. и 1,8-А.)-светло-желтые
кристаллы (см. табл.); не раств. в неполярных орг. р-рителях, умеренно
раств. в спирте. А.-сильные к-ты; при взаимод. с SOC12, POC13,
РС15 образуют сульфохлориды; при нагр. с разб. H2SO4
десульфируются, причем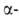 сульфокислоты
легче, чем
сульфокислоты
легче, чем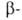 сульфокислоты;
восстанавливаются Zn в водном NH3 до сульфокислот антрацена,
а при действии Na2S2O4 в водно-щелочном
р-ре - до сульфокислот 9,10-антрагидрохинона. При нитровании или сульфировании
1-А. и 2-А. нитро- или сульфогруппа вступает в незамещенное ядро антрахинона.
Напр., из 1-А. образуются смеси 1-нитроантрахинон-5- и 1-нитроантрахинон-8-сульфокислот,
из 2-А. - 1-нитроантрахинон-6- и 1-нитроантрахинон-7-сульфокислот. Сульфогруппа
в А. обменивается на амино-, гидрокси-, алкил(арил)гидроксигруппы, атом
хлора, причем в случае
сульфокислоты;
восстанавливаются Zn в водном NH3 до сульфокислот антрацена,
а при действии Na2S2O4 в водно-щелочном
р-ре - до сульфокислот 9,10-антрагидрохинона. При нитровании или сульфировании
1-А. и 2-А. нитро- или сульфогруппа вступает в незамещенное ядро антрахинона.
Напр., из 1-А. образуются смеси 1-нитроантрахинон-5- и 1-нитроантрахинон-8-сульфокислот,
из 2-А. - 1-нитроантрахинон-6- и 1-нитроантрахинон-7-сульфокислот. Сульфогруппа
в А. обменивается на амино-, гидрокси-, алкил(арил)гидроксигруппы, атом
хлора, причем в случае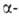 сульфокислот
легче, чем в случае
сульфокислот
легче, чем в случае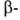 сульфокислот.
Так, 1-А. с Са(ОН)2 под давлением образует 1-гидроксиантрахинон,
с конц. водным р-ром NH3 при 160-180°С-1-аминоантрахинон, являющийся
промежут. продуктом в синтезе антрахиноновых кислотных и кубовых красителей;
при кипячении в водном солянокислом р-ре с КС1О3 или при пропускании
газообразного С12 в солянокислый р-р с добавлением NH4C1
A. образуют соотв. хлор- или дихлорантрахиноны - промежут. продукты в произ-ве
кубовых красителей.
сульфокислот.
Так, 1-А. с Са(ОН)2 под давлением образует 1-гидроксиантрахинон,
с конц. водным р-ром NH3 при 160-180°С-1-аминоантрахинон, являющийся
промежут. продуктом в синтезе антрахиноновых кислотных и кубовых красителей;
при кипячении в водном солянокислом р-ре с КС1О3 или при пропускании
газообразного С12 в солянокислый р-р с добавлением NH4C1
A. образуют соотв. хлор- или дихлорантрахиноны - промежут. продукты в произ-ве
кубовых красителей.

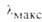 , им
, им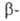 положение,
а в присут. сульфата Нg(П) - в
положение,
а в присут. сульфата Нg(П) - в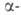 положение.
Из-за малого различия в скоростях вступления первой и второй сульфогрупп
в ядро процесс ведут так, чтобы при получении моносульфокислот в р-цию
вступало не более 50-70% антрахинона. После проведения р-ции массу разбавляют
водой, отфильтровывают непрореагировавший антрахинон, а из фильтрата, добавляя
КС1 или NaCl, выделяют 1-А. в виде К-соли или 2-А. в виде Na-соли ("серебристая
соль"). При получении 1,5-А. и 1,8-А. сульфирование в присут. соединений
Hg(II) проводят при более высокой т-ре или удлиняют время р-ции; изомерные
сульфокислоты разделяют дробной кристаллизацией: 1,5-А.-в виде динатриевой,
1,8-А. - в виде дикалиевой соли. Использование соединений Hg(II) осложняет
обезвреживание отходов произ-ва 1-А., 1,5-А. и 1,8-А. Др. способ синтеза
А.-сульфирование антрацена с послед. разделением изомерных сульфокислот
и окислением.
положение.
Из-за малого различия в скоростях вступления первой и второй сульфогрупп
в ядро процесс ведут так, чтобы при получении моносульфокислот в р-цию
вступало не более 50-70% антрахинона. После проведения р-ции массу разбавляют
водой, отфильтровывают непрореагировавший антрахинон, а из фильтрата, добавляя
КС1 или NaCl, выделяют 1-А. в виде К-соли или 2-А. в виде Na-соли ("серебристая
соль"). При получении 1,5-А. и 1,8-А. сульфирование в присут. соединений
Hg(II) проводят при более высокой т-ре или удлиняют время р-ции; изомерные
сульфокислоты разделяют дробной кристаллизацией: 1,5-А.-в виде динатриевой,
1,8-А. - в виде дикалиевой соли. Использование соединений Hg(II) осложняет
обезвреживание отходов произ-ва 1-А., 1,5-А. и 1,8-А. Др. способ синтеза
А.-сульфирование антрацена с послед. разделением изомерных сульфокислот
и окислением.
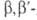 дисульфокислоты
антрахинона - катализаторы окислит.-восстановит. процессов; препятствуют
образованию вуали в фотографии.
дисульфокислоты
антрахинона - катализаторы окислит.-восстановит. процессов; препятствуют
образованию вуали в фотографии.