АРОМАТИЧНОСТЬ
(от греч. aroma, род. падеж aromatos - благовоние),
понятие, характеризующее совокупность структурных, энергетич. св-в и особенностей
реакц. способности циклич. структур с системой сопряженных связей. Термин
введен Ф. А. Кекуле (1865) для описания св-в соединений, структурно близких
к бензолу - родоначальнику класса ароматических соединении
.
К числу наиб. важных признаков А. принадлежит склонность ароматич. соед.
к замещению, сохраняющему систему сопряженных связей в цикле, а не к присоединению,
разрушающему эту систему. Кроме бензола и его производных, такие р-ции
характерны для полицикли ч. ароматич. углеводородов (напр., нафталина,
антрацена, фенантрена и их производных), а также для изоэлектронных им
сопряженных гетероциклич. соединений. Известно, однако, немало соед. (азулен,
фульвен и др.), к-рые также легко вступают в р-ции замещения, но не обладают
всеми др. признаками А.
Реакц. способность не может служить точной характеристикой А. еще и
потому, что она отражает св-ва не только осн. состояния данного соединения,
но и переходного состояния (активиров. комплекса) р-ции, в к-рую это соед.
вступает. Поэтому более строгие критерии А. связаны с анализом физ. св-в
осн. электронных состояний циклич. сопряженных структур. Главная трудность
состоит в том, что А. не является экспериментально определяемой характеристикой.
Поэтому не существует однозначного критерия для установления степени А.,
т.е. степени подобия св-вам бензола. Ниже рассмотрены наиб. важные признаки
А.
Строение электронной оболочки ароматических систем.
Тенденция бензола и его производных к сохранению структуры сопряженного
кольца в разл. превращениях означает повыш. термодинамич. и кинетич. устойчивость
этого структурного фрагмента. Стабилизация (понижение электронной энергии)
молекулы или иона, обладающих циклич. структурой, достигается при полном
заполнении электронами всех связывающих молекулярных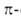 орбиталей
и вакантности несвязывающих и антисвязывающих орбиталей. Выполнение этих
условий достигается, когда общее число
орбиталей
и вакантности несвязывающих и антисвязывающих орбиталей. Выполнение этих
условий достигается, когда общее число электронов в циклич. полиене равно (4л + 2), где п = = 0,1,2...
(правило Хюккеля).
электронов в циклич. полиене равно (4л + 2), где п = = 0,1,2...
(правило Хюккеля).
Это правило объясняет устойчивость бензола (ф-ла I) и циклопентадиенильного
аниона (II; п = 1). Оно позволило правильно предсказать устойчивость
циклопропенильного (III; п = 0) и циклогептатриенильного (IV; п = 1) катионов. Ввиду подобия электронных
оболочек соед. II-IV и бензола они, как и высшие циклич. полиены - [10],
[14], [18]аннулены (V-VII), рассматриваются как ароматич. системы.
электронных
оболочек соед. II-IV и бензола они, как и высшие циклич. полиены - [10],
[14], [18]аннулены (V-VII), рассматриваются как ароматич. системы.
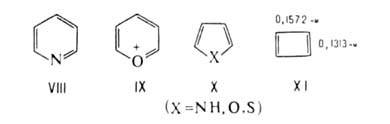
Правило Хюккеля можно экстраполировать на ряд сопряженных гетероциклич.
соед. - производные пиридина (VIII) и катиона пирилия (IX), изоэлектронные
бензолу, пятичленные гетероциклы типа X (пиррол, фуран, тиофен), изоэлектронные
циклопентадиенильному аниону. Эти соединения также относят к ароматич.
системам.
Для производных соединений II-Х и др. более сложных структур, получаемых
изоэлектронным замещением метиновых групп в полиенах I-VII, также характерны
высокая термодинамич. устойчивость и общая склонность к р-циям замещения
в ядре.
Циклич. сопряженные полиены, имеющие в цикле 4n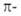 электронов (n=1,2...), неустойчивы и легко вступают в р-ции присоединения,
т. к. обладают незамкнутой электронной оболочкой с частично заполненными
несвязывающими орбиталями. Такие соединения, наиб. типичным примером к-рых
служит циклобутадиен (XI), относят кантиароматич. системам.
электронов (n=1,2...), неустойчивы и легко вступают в р-ции присоединения,
т. к. обладают незамкнутой электронной оболочкой с частично заполненными
несвязывающими орбиталями. Такие соединения, наиб. типичным примером к-рых
служит циклобутадиен (XI), относят кантиароматич. системам.
Правила, учитывающие число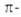 электронов
в цикле, полезны для характеристики св-в моноциклич. структур, однако неприложимы
к полициклам. При оценке А. последних необходимо учитывать, как соответствуют
этим правилам
электронов
в цикле, полезны для характеристики св-в моноциклич. структур, однако неприложимы
к полициклам. При оценке А. последних необходимо учитывать, как соответствуют
этим правилам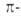 электронные оболочки каждого отдельного цикла молекулы. С осторожностью
следует пользоваться ими и в случае многозаряженных циклич. ионов. Так,
электронные оболочки дикатиона и дианиона циклобутадиена отвечают требованиям
правила Хюккеля. Однако эти структуры нельзя относить к ароматическим,
т. к. дикатион (п = 0) устойчив не в плоской форме, обеспечивающей
циклич. сопряжение, а в согнутой по диагонали; дианион (n=1) вообще неустойчив.
электронные оболочки каждого отдельного цикла молекулы. С осторожностью
следует пользоваться ими и в случае многозаряженных циклич. ионов. Так,
электронные оболочки дикатиона и дианиона циклобутадиена отвечают требованиям
правила Хюккеля. Однако эти структуры нельзя относить к ароматическим,
т. к. дикатион (п = 0) устойчив не в плоской форме, обеспечивающей
циклич. сопряжение, а в согнутой по диагонали; дианион (n=1) вообще неустойчив.
Энергетические критерии ароматичности. Энергия резонанса. Для
определения количеств. меры А., характеризующей повыш. термодинамич. устойчивость
ароматич. соед., было сформулировано понятие энергии резонанса (ЭР), или
энергии делокализации.
Теплота гидрирования молекулы бензола, формально содержащей три двойные
связи, на 151 кДж/моль больше, чем теплота гидрирования трех молекул этилена.
Эту величину, связываемую с ЭР, можно рассматривать как энергию, дополнительно
затрачиваемую на разрушение циклич. системы сопряженных двойных связей
бензольного кольца, стабилизирующей эту структуру. Т. обр., ЭР характеризует
вклад циклич. сопряжения в теплоту образования (полную энергию, теплоту
атомизации) соединения.
Предложен ряд способов теоретич. оценок ЭР. Они различаются гл. обр.
выбором структуры сравнения (т.е. структуры, в к-рой нарушено циклич. сопряжение)
с циклич. формой. Обычный подход к вычислению ЭР состоит в сопоставлении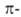 электронных
энергий
электронных
энергий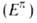 циклич.
структуры и суммы энергий всех изолированных кратных связей, содержащихся
в ней. Однако рассчитываемые т. обр. ЭР, независимо от используемого квантовохим.
метода, имеют тенденцию к возрастанию с увеличением размеров
циклич.
структуры и суммы энергий всех изолированных кратных связей, содержащихся
в ней. Однако рассчитываемые т. обр. ЭР, независимо от используемого квантовохим.
метода, имеют тенденцию к возрастанию с увеличением размеров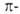 системы.
Это нередко противоречит эксперим. данным о св-вах ароматич. системы. Так,
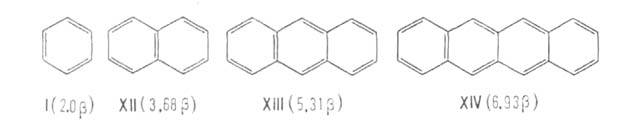
А. в ряду полиаценовбензол (I), нафталин (XII), антрацен (XIII), тетрацен
(XIV) понижается (напр., возрастает склонность к присоединению, увеличивается
альтернирование длин связей), а ЭР (приведены в единицах
системы.
Это нередко противоречит эксперим. данным о св-вах ароматич. системы. Так,
А. в ряду полиаценовбензол (I), нафталин (XII), антрацен (XIII), тетрацен
(XIV) понижается (напр., возрастает склонность к присоединению, увеличивается
альтернирование длин связей), а ЭР (приведены в единицах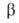 =
75 кДж/моль) растут:
=
75 кДж/моль) растут:
Этого недостатка лишены величины ЭР, рассчитываемые путем сравнения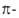 электронных
энергий циклич. структуры и аналогичного ациклич. сопряженного полнена
(М. Дьюар, 1969). Рассчитанные т. обр. величины принято называть ЭР Дьюара
(ЭРД). Напр., ЭРД бензола (1,013) вычисляется при сопоставлении его
электронных
энергий циклич. структуры и аналогичного ациклич. сопряженного полнена
(М. Дьюар, 1969). Рассчитанные т. обр. величины принято называть ЭР Дьюара
(ЭРД). Напр., ЭРД бензола (1,013) вычисляется при сопоставлении его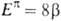 с
с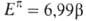 1,3,5-гексатриена,
а ЭРД циклобутадиена
1,3,5-гексатриена,
а ЭРД циклобутадиена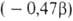 -сопоставлением
его
-сопоставлением
его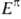 =
=
=
=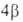 с
с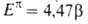 1,3-бутадиена.
1,3-бутадиена.
Соединения с положит. значениями ЭРД относят к ароматическим, с отрицательными-к
антиароматическим, а со значениями ЭРД, близкими к нулю, - к неароматическим.
Хотя значения ЭРД варьируют в зависимости от приближений квантовохим. метода
расчета, относит. порядок их практически не зависит от выбора метода. Ниже
приведены ЭРД в расчете на один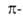 электрон
(ЭРД/е; в единицах
электрон
(ЭРД/е; в единицах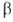 ),
вычисленные по модифициров. методу молекулярных орбиталей Хюккеля:
),
вычисленные по модифициров. методу молекулярных орбиталей Хюккеля:

Наиб. ЭРД/е, то есть наиб. А., обладает бензол. Понижение ЭРД/е отражает
понижение ароматич. св-в. Приведенные данные хорошо согласуются со сложившимися
представлениями о проявлениях А.
Магнитные критерии ароматичности. Циклич. сопряжение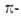 электронов приводит к возникновению в молекуле кольцевого тока, к-рый вызывает
экзальтацию диамагн. восприимчивости. Поскольку величины кольцевого тока
и экзальтации отражают эффективность циклич. сопряжения, они м. б. использованы
как количеств. мера А.
электронов приводит к возникновению в молекуле кольцевого тока, к-рый вызывает
экзальтацию диамагн. восприимчивости. Поскольку величины кольцевого тока
и экзальтации отражают эффективность циклич. сопряжения, они м. б. использованы
как количеств. мера А.
К ароматическим относятся соед., в молекулах к-рых поддерживаются наведенные
диамагнитные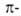 электронные
кольцевые токи (диатропные системы). В случае [4/1 + 2]аннуленов (n = 0,1,2...)
существует прямая пропорциональность между силой кольцевого тока и величиной
ЭРД. Однако для неальтернантных углеводородов (напр., азулена) и гетероциклич.
соед. эта зависимость усложняется. В ряде случаев система м.б. одновременно
и диатропной и антиароматической, напр. бицикло[6,2,0]декапентаен.
электронные
кольцевые токи (диатропные системы). В случае [4/1 + 2]аннуленов (n = 0,1,2...)
существует прямая пропорциональность между силой кольцевого тока и величиной
ЭРД. Однако для неальтернантных углеводородов (напр., азулена) и гетероциклич.
соед. эта зависимость усложняется. В ряде случаев система м.б. одновременно
и диатропной и антиароматической, напр. бицикло[6,2,0]декапентаен.
Наличие индуциров. кольцевого тока в циклич. сопряженных системах характерно
проявляется в спектрах протонного магн. резонанса (ПМР), т.к. ток создает
анизотропное магн. поле, заметно влияющее на хим. сдвиги протонов, связанных
с атомами кольца. Сигналы протонов, расположенных во внутр. части ароматич.
кольца, смещаются в сторону сильного поля, а сигналы протонов, расположенных
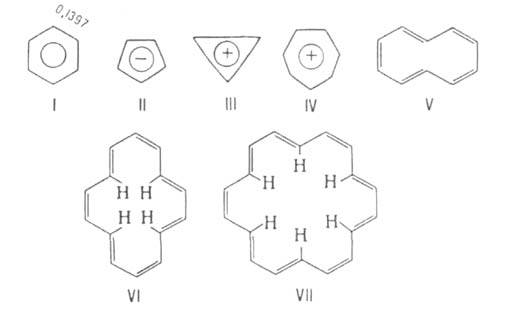
на периферии кольца, - в сторону слабого поля. Так, внутр. протоны [14]аннулена
(ф-ла VI) и [18]аннулена (VII) проявляются при — 60°С в спектре ПМР соотв.
при 0,0 и —2,99м. д., а внешние-при 7,6 и 9,28 м. д.
Для антиароматич. систем [4n]аннуленов, наоборот, характерны парамагн.
кольцевые токи, приводящие к сдвигу внеш. протонов в сильное поле (паратропные
системы). Так, хим. сдвиг внеш. протонов [16]аннулена равен всего 4,8 м.д.
Структурные критерии ароматичности. Важнейшие структурные характеристики
молекулы бензола - ее планарность и полная выравненность связей. Молекулу
можно рассматривать как ароматическую, если длины углерод-углеродных связей
в ней лежат в пределах 0,136-0,143 нм, т.е. близко к 0,1397 нм для молекулы
бензола (I). Для нециклич. сопряженных полиеновых структур длины связей
С—С составляют 0,144-0,148 нм, а связей С=С-0,134-0,135 нм. Еще большее
альтернирование длин связей характерно для антиароматич. структур. Это
подтверждается данными строгих неэмпирич. расчетов геометрич. параметров
циклобутадиена и эксперим. данными для его производных.
Предложены разл. выражения для количеств. характеристики А. по степени
альтернирования длин связей, напр. для углеводородов вводится индекс А.
(НОМАd):
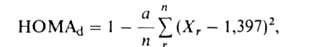
где а = 98,89, Хr- длина r-ной связи (в А),
n-число связей. Для бензола HOMAd максимален и равен 1, для
циклобутадиена минимален (0,863). Азулен с НОМАd = 0,921 занимает
промежут. положение, характерное для неароматич. систем.
Развитие концепции ароматичности. Главная характеристика - энергетич.
стабилизация структуры при молекулярной геометрии, создающей оптимальные
условия для соответствующих электронных взаимодействий. Установление аналогичных
связей между пространственным и электронным строением молекул др. структурных
типов привело к расширению понятия А.
Повыш. устойчивость гомосопряженных систем (относительно др. изомерных
форм), в к-рых число электронов
равно (4n + 2), привела к выработке понятия гомоароматичности. Представителями
гомоароматич. систем служат, напр., 1,3,5-циклогептатриен (гомобензол;
XV) и трис-гомоциклопропенильный катион (XVI).
электронов
равно (4n + 2), привела к выработке понятия гомоароматичности. Представителями
гомоароматич. систем служат, напр., 1,3,5-циклогептатриен (гомобензол;
XV) и трис-гомоциклопропенильный катион (XVI).
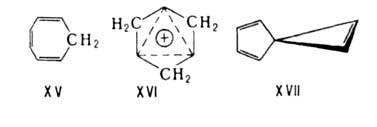
К спироароматич. системам принадлежат ненасыщ. спирановые структуры,
в к-рых перекрывание двух ортогональных систем орбиталей
приводит к стабилизирующему эффекту. Последний достигается, когда число
орбиталей
приводит к стабилизирующему эффекту. Последний достигается, когда число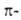 электронов в обоих циклах равно (4п + 2), напр. в [4,2]спирарене
(XVII).
электронов в обоих циклах равно (4п + 2), напр. в [4,2]спирарене
(XVII).
Понятие А. привлекается даже для характеристики энергетически устойчивых
нециклич. структур [напр., дианиона триметилена и его изоэлектронного аналога
гуанидина (ХУШ)]-Y-ароматичность; для насыщ. циклов [напр., циклоалканов
с нечетным числом метиленовых звеньев, как циклопропан (XIX)] - сигма-ароматичность;
трехмерных каркасных структур - трехмерная ароматичность.
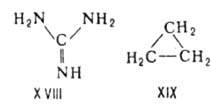
Примеры структур с трехмерной А.-углеводородные катионы (СН)5+
(ф-ла XX), (СН)62+ (XXIX производные к-рых известны,
нидо- и клозокарбораны (XXII и ХХIII),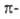 комплексы
типа железа карбонилов
и др. (см. Карбонилы металлов
), сэндвичевые
структуры типа ферроцена
, металлоорг. кластеры-производные переходных
металлов. Во всех этих структурах реализуется замкнутая оболочка валентных
электронов, заполняющих только связывающие молекулярные орбитали. Для разл.
типов каркасных структур, напр. пирамидальных, сэндвичевых, бипирамидальных,
разработаны специфич. правила электронного счета, определяющие их устойчивость,
т.е. ароматичность.
комплексы
типа железа карбонилов
и др. (см. Карбонилы металлов
), сэндвичевые
структуры типа ферроцена
, металлоорг. кластеры-производные переходных
металлов. Во всех этих структурах реализуется замкнутая оболочка валентных
электронов, заполняющих только связывающие молекулярные орбитали. Для разл.
типов каркасных структур, напр. пирамидальных, сэндвичевых, бипирамидальных,
разработаны специфич. правила электронного счета, определяющие их устойчивость,
т.е. ароматичность.
Понятие А. успешно привлекается для описания энергетич. характеристик
переходных состояний термич. перициклич. р-ций. Такие р-ции осуществляются
через переходные состояния, к-рые в зависимости от конформации цикла содержат
4n+2 (хюккелевские системы) или 4n (мебиусовские системы)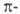 электронов.
электронов.
Лит.: ГерретП.Дж., в кн.: Общая органическая химия, пер. с англ., т.
1, М., 1981, с. 281-314; Глуховцев М. Н. [и др.], "Успехи химии", 1985,
т. 54, № 1, с. 86-125; Lewis D., Peters D., Facts and theories of aromaticity,
L.-Basingstoke, 1975; Dewar M.J.S., McKee M.L, "Pure Appl Chem.", 1980,
v. 52, №6, p. 1431-41; MinkinV.L, MinyaevR.M., в кн.: Progress in theoretical
organic chemistry, v. 3, Amst.-[a.o.], 1982, p. 121-55. В.И. Минкин.

