АСПАРАГИНОВАЯ КИСЛОТА
(аминоянтарная к-та, Asp, D) HOOCCH2CH(NH2)COOH,
мол.м. 133,1; бесцв. кристаллы. Для D, L-, L- и D-A.к. т.пл. соотв. 280,
270 и 300°С (все изомеры плавятся с разл.). Для L- и D-A. к.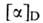 соотв. + 25° (20°С; концентрация 1,97 г в 100 мл 6н. НС1) и - 23° (27 °С;
концентрация 2,3 г в 6н. НС1). А. к. плохо раств. в воде, не раств. в орг.
р-рителях; при 25°С рКа 1,88 (
соотв. + 25° (20°С; концентрация 1,97 г в 100 мл 6н. НС1) и - 23° (27 °С;
концентрация 2,3 г в 6н. НС1). А. к. плохо раств. в воде, не раств. в орг.
р-рителях; при 25°С рКа 1,88 (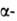 СООН),
3,65 (
СООН),
3,65 (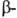 СООН),
9,6 (NH2); p/ 2,77. А.к.-типичная алифатич.
СООН),
9,6 (NH2); p/ 2,77. А.к.-типичная алифатич.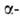 аминокислота. L-Изомер играет важную роль в организме при переаминировании,
биосинтезе мочевины, пиримидиновых оснований; метаболизирует до фумаровой
к-ты. При синтезе из А. к. пептидов защищают
аминокислота. L-Изомер играет важную роль в организме при переаминировании,
биосинтезе мочевины, пиримидиновых оснований; метаболизирует до фумаровой
к-ты. При синтезе из А. к. пептидов защищают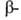 карбоксильную
группу
бензильным или трет-бутилъным остатками. Таким же путем, а также амидированием
карбодиимидами осуществляют хим. модификацию
карбоксильную
группу
бензильным или трет-бутилъным остатками. Таким же путем, а также амидированием
карбодиимидами осуществляют хим. модификацию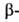 карбоксильной
группы остатков А. к. в молекулах белков.
карбоксильной
группы остатков А. к. в молекулах белков.
L-A.к. - кодируемая аминокислота. Встречается во всех организмах в своб.
виде и в составе белков. Ее биосинтез осуществляется в результате изомеризации
треонина в гомосерии с послед. его окислением или в результате гидролиза
аспарагина. Выделяют L-А.к. из белковых гидролизатов. Рацемат А. к. получают
конденсацией ацетаминомалонового эфира с эфиром хлоруксусной к-ты с послед.
гидролизом и декарбоксилированием продуктов конденсации или кислотным гидролизом
аспарагина. Методы выделения и анализа А. к. основаны на нерастворимости
ее Са-и Ва-солей. В спектре ЯМР L-А. к. в D2O хим. сдвиги для
протонов у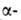 и
и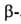 атомов
углерода составляют соотв. 3,984 и 2,939, 2,861 м.д. L-Изомер применяют
для синтеза пептидов, в смеси с др. аминокислотами - для парэнтерального
питания. Впервые выделена Г. Ритхаузеном в 1868 из белков конглутина и
легумина. Мировое произ-во ок. 250 т/год (1982). В. В. Баев.
атомов
углерода составляют соотв. 3,984 и 2,939, 2,861 м.д. L-Изомер применяют
для синтеза пептидов, в смеси с др. аминокислотами - для парэнтерального
питания. Впервые выделена Г. Ритхаузеном в 1868 из белков конглутина и
легумина. Мировое произ-во ок. 250 т/год (1982). В. В. Баев.
|

