АТОМНЫЕ СПЕКТРЫ
, оптич. спектры, получающиеся при испускании
или поглощении электромагн. излучения свободными или слабо связанными атомами
(напр., в газах или парах). Являются линейчатыми, т.е. состоят из отдельных
спектральных линий, характеризуемых частотой излучения v, к-рая соответствует
квантовому переходу между уровнями энергии Ei и Ek
атома согласно соотношению: hv = Ei-Ek
где h-постоянная Планка. Спектральные линии можно характеризовать
также длиной волны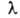 =
c/v (с - скорость света), волновым числом
=
c/v (с - скорость света), волновым числом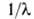 =
v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1,
длины волн-в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов
- в эВ. Типичные А. с. наблюдаются в видимой, УФ- и ближней ИК-областях
спектра. Спектры испускания, или эмиссионные, получают при возбуждении
атомов разл. способами (фотонами, электронным ударом и т.д.), спектры поглощения,
или абсорбционные, - при прохождении электромагн. излучения, обладающего
непрерывным спектром, через атомарные газы или пары. Для наблюдения А.
с. применяют приборы с фотографич. или фотоэлектрич. регистрацией.
=
v/c и энергией фотона hv. Частоты спектральных линий выражают в с -1,
длины волн-в нм и мкм, а также в А, волновые числа - в см -1, энергии фотонов
- в эВ. Типичные А. с. наблюдаются в видимой, УФ- и ближней ИК-областях
спектра. Спектры испускания, или эмиссионные, получают при возбуждении
атомов разл. способами (фотонами, электронным ударом и т.д.), спектры поглощения,
или абсорбционные, - при прохождении электромагн. излучения, обладающего
непрерывным спектром, через атомарные газы или пары. Для наблюдения А.
с. применяют приборы с фотографич. или фотоэлектрич. регистрацией.
А.с. обладают ярко выраженной индивидуальностью: каждому элементу соответствует
свой спектр нейтрального атома (т. наз. дуговой спектр) и свои спектры
последовательно образующихся положит. ионов (т.наз. искровые спектры).
Линии в этих спектрах обозначают римскими цифрами, напр. линии PeI, FeII,
FeIII в спектрах железа соответствуют спектрам Fe, Fe+, Fe2+.
Вид спектра зависит как от электронного строения данного атома, так
и от внеш. условий - т-ры, давления, напря-женностей электрич. и магн.
полей и т. п. В зависимости от способа возбуждения атома могут возникать
отдельные линии спектра, нек-рые его участки, весь спектр нейтрального
атома или его иона определенной кратности. Положение линий в таких спектрах
подчиняется определенным закономерностям, к-рые наиб. просты для атомов
с одним внеш. электроном, т.е. для атома Н и нейтральных атомов щелочных
металлов, а также изоэлектронных с ними ионов. В спектрах таких атомов
наблюдаются спектральные серии, каждая из к-рых (в случае спектров испускания)
получается при возможных квантовых переходах с последовательных вышележащих
уровней энергии на один и тот же нижележащий (в спектрах поглощения - при
обратных переходах). Промежутки между линиями одной серии убывают в сторону
больших частот, т.е. линии сходятся к границе серии - максимальной для
данной серии частоте, соответствующей ионизации атома. Для атома Н волновые
числа линий всех серий (см. рис. 1 в ст. Атом) с большой точностью
определяются обобщенной ф-лой Бальмера:
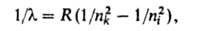
где пk и ni - значения главного квантового
числа для уровней энергии, между к-рыми происходит квантовый переход, причем
nk, характеризующее нижний уровень энергии, определяет серию,
а ni - ее отдельные линии (при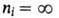 получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются
и в спектрах водородоподобных атомов, однако значения волновых чисел для
спектральных линий ионов Не+ , Li2+, ... в Z2
раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий
атома Н.
получается граница серии); R-постоянная Ридберга. Аналогичные серии наблюдаются
и в спектрах водородоподобных атомов, однако значения волновых чисел для
спектральных линий ионов Не+ , Li2+, ... в Z2
раз (Z - пoрядковый номер элемента) больше, чем для соответствующих линий
атома Н.
Спектры атомов щелочных металлов, имеющих один электрон на внеш. электронной
оболочке, схожи со спектром Н, но смещены в область меньших частот; число
спектральных линий в них увеличивается, а закономерности в расположении
линий усложняются. Пример - спектр Na, атом к-рого имеет электронную конфигурацию
Is22s22p63s с легковозбуждаемым внеш.
электроном 3s. Переходу этого электрона из состояния Зр в состояние 35
соответствует желтая линия Na (дублет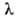 =
589,0 нм и
=
589,0 нм и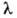 =
589,6 нм); это - наиб. яркая линия, с к-рой начинается т.наз, главная серия
Na. Линии этой серии в спектре испускания соответствуют переходам из состояний
Зр, 4р, 5р> ... в состояние 35.
=
589,6 нм); это - наиб. яркая линия, с к-рой начинается т.наз, главная серия
Na. Линии этой серии в спектре испускания соответствуют переходам из состояний
Зр, 4р, 5р> ... в состояние 35.
Для атомов послед. групп элементов в периодич. системе, обладающих двумя
или неск. внеш. электронами, спектры еще более усложняются, что обусловлено
взаимод. электронов. Особенно сложны спектры атомов с заполняющимися d- и f-оболочками; число линий в таких спектрах достигает мн. тысяч, простых
закономерностей в них не обнаруживается. Однако и для сложных спектров
можно произвести систематику оптич. квантовых переходов и определить схему
уровней энергии. Систематика спектров атомов с двумя и более внеш. электронами
основана на приближенной характеристике отдельных электронов при помощи
квантовых чисел n и l с учетом взаимод. этих электронов друг с другом.
При этом приходится учитывать как их электростатич. взаимод., так и спин-орбитальное,
что приводит к расщеплению уровней энергии (т. наз. тонкая структура).
В результате этого взаимод. у большинства атомов каждая спектральная линия
представляет собой более или менее тесную группу линий - мультиплет. Так,
у всех щелочных металлов наблюдаются двойные линии (дублеты), причем расстояния
между линиями увеличиваются с увеличением порядкового номера элемента.
Для щел.-зем. элементов наблюдаются одиночные линии (синглеты) и тройные
(триплеты). В спектрах атомов послед. групп периодич. системы элементов
наблюдаются еще более сложные мультиплеты, причем атомам с нечетным числом
электронов соответствуют четные мультиплеты (дублеты, квартеты), а с четным
числом - нечетные (триплеты, квинтеты). Кроме тонкой структуры в А. с.
наблюдается также сверхтонкая структура линий (примерно в 1000 раз уже,
чем мультиплетная), обусловленная взаимод. электронов с магн. и электрическими
моментами ядра.
В А. с. проявляются не все возможные квантовые переходы, а лишь разрешенные
правилами отбора. Так, в случае атома с одним внеш. электроном разрешены
лишь переходы между уровнями, для к-рых орбитальное квантовое число / изменяется
на 1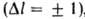 ,
т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями
(l = 2) и т.д. Количеств. характеристика разрешенного оптич. квантового
перехода - его вероятность, определяющая интенсивность спектральной линии,
соответствующей этому переходу. Вероятности переходов в простейших случаях
м.б. рассчитаны методами квантовой механики.
,
т. е. s-уровни (l = 0) комбинируют с р-уровнями (l=1), р-уровни - с d-уровнями
(l = 2) и т.д. Количеств. характеристика разрешенного оптич. квантового
перехода - его вероятность, определяющая интенсивность спектральной линии,
соответствующей этому переходу. Вероятности переходов в простейших случаях
м.б. рассчитаны методами квантовой механики.
Под влиянием внеш. электрич. и магн. полей происходит расщепление спектральных
линий. Возмущающие факторы, существующие в излучающей среде, вызывают уширение
и сдвиг спектральных линий.
Методы, основанные на измерении частот и интенсивно" стей линий в спектре,
применяют для решения разл. задач спектроскопии: проведения общей систематики
спектров многоэлектронных атомов; определения уровней энергии таких атомов
(это существенно, в частности, при квантово-хим расчетах); нахождения вероятностей
переходов и времен жизни возбужденных состояний; изучения механизмов возбуждения
атомов; измерения ядерных моментов и т. п. Индивидуальность А. с. используют
для качеств. определения элементного состава в-ва, а зависимость интенсивности
линий от концентрации излучающих атомов - для количеств. анализа (см. Спектральный анализ
).
Исследования А. с. сыграли важнейшую роль в развитии представлений о
строении атома.
Лит.: Кондон Е., Шортли Г., Теория атомных спектров, пер. с англ.,
М., 1949; Ельяшевич М, А., Атомная и молекулярная спектроскопия, М., 1962;
Фриш С.Э., Оптические спектры атомов, M.-JL, 1963; Собельман И. И., Введение
в теорию атомных спектров, М., 1977; Progress in atomic spectroscopy, pt.
A-B, N.Y.. 1978-79. М.А. Ельяшевич.

