ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
, последовательность
расположения электродов в порядке возрастания их стандартных электродных
потенциалов (см. Стандартный потенциал
).
Металлич. электроды в водном
р-ре электролита образуют след. Э. р. н.: Li, К, Rb, Ba, Sr, Ca, Na, Се,
Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2,
Bi, Cu, Hg, Ag, Pt, O2, Au. Ддя сравнения включены водородный
электрод (Pt, H2[l атм] | Н+ ), потенциал к-рого
при давлении водорода 1,01 x 105 Па и термодинамич. активности
а ионов Н+ в водном р-ре, равной 1, при всех т-рах принимается
равным нулю (потенциалопределяющая р-ция Н+ + е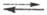 1/2Н2,
где е - электрон) и кислородный электрод (потенциалопределяющая р-ция О2
+ 2Н2О + 4е
1/2Н2,
где е - электрон) и кислородный электрод (потенциалопределяющая р-ция О2
+ 2Н2О + 4е 4ОН-).
4ОН-).
Э. р. н. позволяет судить о термодинамич.
возможности протекания тех или иных электродных процессов. Металл с более
отрицат. потенциалом может вытеснять металл с менее отрицат. потенциалом
из р-ров его солей, растворяясь при этом. Металлы, имеющие отрицат. стандартный
потенциал по сравнению с водородным электродом (т. наз. электроотрицат.
металлы), в р-рах с не слишком большой термодинамич. активностью ионов
металла имеют более отрицат. потенциал, чем водородный электрод в сильно
кислых р-рах. Поэтому при замыкании такого электрода с водородным между
ними протекает ток, металл растворяется, а на водородном электроде выделяется
водород (см. Анодное растворение
). Электроотрицат. металлы термодинамически
неустойчивы в водных р-рах (их наз. неблагородными металлами) и осаждаются
на катоде при более отрицат. потенциале, чем потенциал выделения Н2
(см. Электроосаждение
).
Металлы, потенциал к-рых менее положительный,
чем у кислородного электрода, термодинамически неустойчивы в контакте с
О2 (или воздухом) и водой. Поэтому Э. р. н. служит для ориентировочных
оценок скорости электрохим. коррозии в водных р-рах при обычных т-рах,
а также для выбора безопасных контактных пар (гальванич. пар) разнородных
металлов. Если металл электроотрицательнее, чем Н2, то может
идти активный коррозионный процесс (см. Коррозия металлов
, Коррозионностойкие материалы
, Электрохимическая защита
). Практич. реализация электродных
процессов определяется наряду с термодинамич. также и кинетич. факторами
(см. Электрохимическая кинетика
).
Положение в Э. р. н. металлов, образующих
ионы разного заряда, зависит от природы соответствующих ионов. Аналогичные
ряды напряжений можно построить для неметаллич. и редокс-электродов (окислит.-восстановительных).
О. А. Петрий.
|

