|
Реклама |
|
|
 |
Молекула Б. - плоский правильный шестиугольник с внутр. углами 120°
и расстоянием между атомами углерода 0,139 нм. В УФ-спектре в этаноле максимумы
при 184 нм (lg Б. - родоначальник углеводородов ароматич. ряда. Хим. св-ва определяются
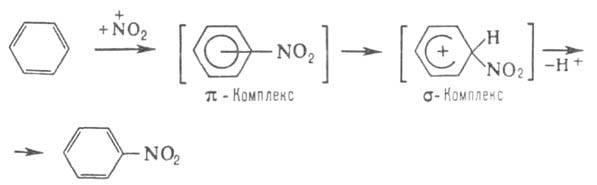
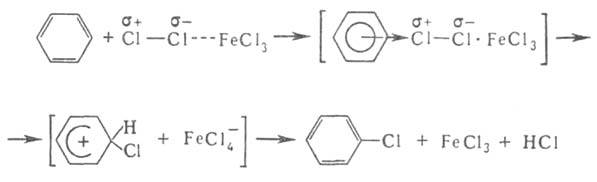
наличием в молекуле стабильной замкнутой системы Катализаторы электроф. замещения - обычно к-ты Льюиса, облегчающие образование
промежут. комплексов и ускоряющие основную р-цию, напр. хлорирование:
Б. сульфируется до бензолсульфокислот, алкилируется олефинами с образованием алкилбензолов. В зависимости от природы первого введенного заместителя дальнейшее электроф. замещение направляется преим. в орто- и пара-положения или в мета-положение. Для Б. характерна устойчивость к действию высоких т-р и окислителей.
Лишь выше 650°С он частично превращ. в дифенил, выше 750°С разлагается
на углерод и водород. Б. не изменяется под действием Н2СrO4
и КМnО4, с О2 в присут. катализаторов (V, Мо) при
350^450°С образует малеиновый ангидрид. Гидрируется до циклогексана в присут.
разл. катализаторов (напр., в присут. Ni при 120-200°С и 2,96-6,94 МПа).
Щелочными металлами в жидком NH3 восстанавливается до 1,4-циклогексадиена.
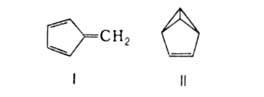
При фотохим. присоединении хлора превращ. в гексахлорциклогексан. При УФ-облучении
способен к циклоприсоединению и изомеризации в фульвен (ф-ла I) и бензвален
(II).
Наиб. старый метод пром. получения Б.: выделение его из предварительно охлажденных пирогазовых продуктов коксования каменных углей абсорбцией орг. поглотителями, напр. маслами кам.-уг. и нефтяного происхождения; для отделения поглотителя используют перегонку с водяным паром. От примесей (напр., тиофена) сырой бензол отделяют гидроочисткой. Осн. кол-во Б. получают риформингом (470-550°С) нефтяной фракции, выкипающей при 62-85 °С; извлекают экстракцией. Б. высокой чистоты получают экстрактивной перегонкой с ДМФА. Б. выделяют также из жидких продуктов пиролиза нефтепродуктов, образующихся в произ-ве этилена и пропилена. При избытке ресурсов толуола Б. производят деалкилированием последнего, к-рое проводят термич. способом при 600-820°С в присут Н2 и водяного пара или каталитически при 227-627°С в присут. цеолитов или оксидных катализаторов. наиб. экономически выгодно выделение Б. из продуктов пиролиза, но ресурсы этого источника недостаточны, поэтому б.ч. его производят риформингом. Доля коксохим. Б. в общем балансе невелика. В лабораториях особо чистый Б. синтезируют декарбоксилированием бензойной к-ты. Специфич. р-ция обнаружения Б. в присут. гомологов: встряхивают смесь углеводородов с аммиачным р-ром Ni(CN)2; при наличии Б. выпадает осадок комплексного соед. Ni(CN)2NH3(C6H6). Осн. области применения Б. (более 80%): произ-во этилбензола, кумола и циклогексана; остальное кол-во - для получения анилина, малеинового ангидрида, как компонент моторного топлива для повышения октанового числа, как р-ритель и экстрагент в произ-ве лаков, красок, ПАВ и др. Для Б. т. всп. - 11 °С, т. самовоспл. 534°С, КПВ 1,5-8%. Сильно раздражает кожу; в высоких концентрациях Б. оказывает судорожное действие; при многократных воздействиях низких концентраций наблюдаются изменения в крови и кроветворных органах; ПДК 5 мг/м3. Транспортируют в железнодорожных цистернах, снабженных оборудованием для разогрева продукта. Б. открыт М. Фарадеем в 1825 при пиролизе китового жира; впервые синтезирован Э. Мичерлихом в 1833 декарбоксилированием бензойной к-ты. Лит.: Соколов В. 3., Харлампович Г. Д., Производство и использование
ароматических углеводородов, М., 1980; Эфрос Л. С., Горелик М. В., Химия
и технология промежуточных продуктов, Л., 1980; Общая органическая химия,
пер. с англ., т. 1, М., 1981, с. 314-455. Н.Н. Артамонова.
|

 0,6468 мПа*с (20 С);
0,6468 мПа*с (20 С);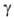 28,18 мН/м (25°С);
28,18 мН/м (25°С);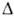 Hoпл
9,843 кДж/моль,
Hoпл
9,843 кДж/моль,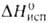 30,77 кДж/моль,
30,77 кДж/моль,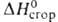 - 3303,72 кДж/моль,
- 3303,72 кДж/моль,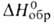 - 82,98 кДж/моль; Sо298 269,38 Дж/(моль*К); ркрит
4,91
МПа, tкрит 289,5 °С;
- 82,98 кДж/моль; Sо298 269,38 Дж/(моль*К); ркрит
4,91
МПа, tкрит 289,5 °С;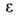 2,284 (20°С). Р-римость в воде 0,073% по массе (25 °С), воды в Б.-0,05%
(26 °С). Неограниченно раств. в углеводородах, эфирах, хуже - в метаноле,
не раств. в этиленгликоле, глицерине; растворяет жиры, каучуки, гудрон,
серу, фосфор, иод. Образует азеотропные смеси (см. табл.).
2,284 (20°С). Р-римость в воде 0,073% по массе (25 °С), воды в Б.-0,05%
(26 °С). Неограниченно раств. в углеводородах, эфирах, хуже - в метаноле,
не раств. в этиленгликоле, глицерине; растворяет жиры, каучуки, гудрон,
серу, фосфор, иод. Образует азеотропные смеси (см. табл.).
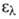 4,77), 203,5 нм (lg
4,77), 203,5 нм (lg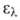 3,87), 254,5 нм (lg
3,87), 254,5 нм (lg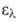 2,31).
2,31).
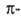 электронов
(см.
электронов
(см. 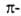 комплексы,
к-рые могут превращ. в более прочные
комплексы,
к-рые могут превращ. в более прочные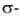 комплексы.
Способностью Б. к комплексообразованию определяется его склонность к электроф.
замещению -наиб. характерным для Б. р-циям, напр.:
комплексы.
Способностью Б. к комплексообразованию определяется его склонность к электроф.
замещению -наиб. характерным для Б. р-циям, напр.: