БЕРИЛЛИЙ
(от греч. beryllion - уменьшит. от beryllos - берилл;
лат. Beryllium) Be, хим. элемент II гр. периодич. системы, ат. н. 4, ат.
м. 9,01218. В природе встречается только один стабильный изотоп 9Ве.
Поперечное сечение захвата тепловых нейтронов 0,90*10-30 м2,
поперечное сечение рассеяния нейтронов 7,54*10-28 м2.
Конфигурация внеш. электронной оболочки 2s2; степени окисления
+2, + 1 (крайне неустойчива); энергия ионизации Ве° -> Be1+
->Ве2+ соотв. 9,3227 и 18,2112 эВ; электроотрицательность по
Полингу 1,5; атомный радиус 0,113 нм; ионный радиус Be2+ 0,030
нм (координац. число 3).
Содержание Б. в земной коре 6*10-4% по массе, в воде морей
и океанов 6*10-7 мг/л. Известно 54 собственно бериллисвых минерала,
важнейшие из них - берилл (и его разновидности - изумруд, аквамарин, гелиодор,
воробьевит, ростерит, бандит) 3ВеО*А12О3*6SiO2
(14,0% ВеО), фенакит 2BeO*SiO2 (45,5% ВеО), бертрандит 4ВеО*2SiO2*Н2О
(36,5% ВеО), гельвин (Mn,Fe,Zn)4[BeSiO4]3S
(11,0-14,2% ВеО). Общие запасы Б. в рудах (в виде берилла и бертрандита)
- 380 тыс. т (1980).
Свойства. Б. - хрупкий твердый металл светло-серого цвета с металлич.
блеском. Имеет две кристаллич. модификации: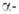 Be
- решетка гексагональная типа Mg(a = 0,22866 нм, с = 0,35833 нм,
z = 2, пространств. группа Р63/mmc);
Be
- решетка гексагональная типа Mg(a = 0,22866 нм, с = 0,35833 нм,
z = 2, пространств. группа Р63/mmc);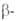 Be - решетка кубическая типа
Be - решетка кубическая типа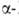 Fe
(a = 0,25515 нм, пространств. группа /mЗm); т-ра перехода
Fe
(a = 0,25515 нм, пространств. группа /mЗm); т-ра перехода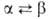 1277°С,
1277°С,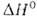 перехода
2,1 кДж/моль. Т. пл. 1287°С, т. кип. 2471 °С; плотн. 1,816 г/см3,
жидкого 1,690 г/см3 (1287°С); для
перехода
2,1 кДж/моль. Т. пл. 1287°С, т. кип. 2471 °С; плотн. 1,816 г/см3,
жидкого 1,690 г/см3 (1287°С); для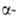 Be
СР° 16,44 Дж/(моль*К), для
Be
СР° 16,44 Дж/(моль*К), для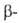 Be
30,0 Дж/(моль*К) (1555 К);
Be
30,0 Дж/(моль*К) (1555 К);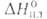 12,6 кДж/моль,
12,6 кДж/моль,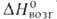 324 кДж/моль (298,15 К),
324 кДж/моль (298,15 К),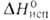 309,9 кДж/моль (2744 К); S°298 9,50 Дж/(моль*К). Ур-ния
температурных зависимостей давления пара соотв. над твердым и жидким Б.:
lg p(Па) = 7,22364 - 16498,359/Т - 0,00047200T + 1,52356 lg T; lg pПа)
= 16,68444 - 17051,58/T+ 0,00002400T - 1,60643 lg Т Температурный коэф.
линейного расширения для Б. 99,9%-ной чистоты при 300-500 К 12*10-6
К-1
(параллельно оси с кристаллич. решетки), 9*10-6
К-1 (перпендикулярно оси с), для Б. с примесями [1,264%
(А1 + Ме)1 13,9*10-6 - 19,6*10-6 К-1 (293-1373
К); температурный коэф. объемного расширения 33,24*10-6 К-1
(273-323 К); теплопроводность для Б. 99,9%-ной чистоты 2930-1464 Вт/(м*К)
(20-95 К), для Б. с примесями [1,264% (Al + Mg)] 194-81 Вт/(м*К) (273-1273
К);
309,9 кДж/моль (2744 К); S°298 9,50 Дж/(моль*К). Ур-ния
температурных зависимостей давления пара соотв. над твердым и жидким Б.:
lg p(Па) = 7,22364 - 16498,359/Т - 0,00047200T + 1,52356 lg T; lg pПа)
= 16,68444 - 17051,58/T+ 0,00002400T - 1,60643 lg Т Температурный коэф.
линейного расширения для Б. 99,9%-ной чистоты при 300-500 К 12*10-6
К-1
(параллельно оси с кристаллич. решетки), 9*10-6
К-1 (перпендикулярно оси с), для Б. с примесями [1,264%
(А1 + Ме)1 13,9*10-6 - 19,6*10-6 К-1 (293-1373
К); температурный коэф. объемного расширения 33,24*10-6 К-1
(273-323 К); теплопроводность для Б. 99,9%-ной чистоты 2930-1464 Вт/(м*К)
(20-95 К), для Б. с примесями [1,264% (Al + Mg)] 194-81 Вт/(м*К) (273-1273
К);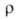 (в
Ом*м] 4,0*10-8 (30К), 6,6*10-8 (293 К), 16*10-8
(600 К), 32*10-8 (1000 К); температурный коэфф.
(в
Ом*м] 4,0*10-8 (30К), 6,6*10-8 (293 К), 16*10-8
(600 К), 32*10-8 (1000 К); температурный коэфф.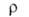 6,6*10-3 К-1 (273-373 К); т-ра перехода в сверхпроводящее
состояние для компактного металла 0,026 К, для тонких пленок, полученных
осаждением из газовой фазы, 5,0-8,2 К; диамагнитен, магн. восприимчивость
-1*10-9 (293 К); стандартный электродный потенциал (Be/Be2+
) —1,7 В;
6,6*10-3 К-1 (273-373 К); т-ра перехода в сверхпроводящее
состояние для компактного металла 0,026 К, для тонких пленок, полученных
осаждением из газовой фазы, 5,0-8,2 К; диамагнитен, магн. восприимчивость
-1*10-9 (293 К); стандартный электродный потенциал (Be/Be2+
) —1,7 В;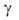 жидкого 1,444 Дж/м2 (1560 К).
жидкого 1,444 Дж/м2 (1560 К).
Мех. св-ва Б. в значительной степени зависят от его чистоты и способа
термич. обработки;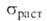 229-573 МПа, предел текучести при растяжении 213-277 МПа, относительное
удлинение 0,36-15,8%, модуль упругости 0,290-0,311 МПа, твердость по Бринеллю
1060-1320 МПа. Для получения заготовок и изделий из Б. в осн. используют
методы порошковой металлургии.
229-573 МПа, предел текучести при растяжении 213-277 МПа, относительное
удлинение 0,36-15,8%, модуль упругости 0,290-0,311 МПа, твердость по Бринеллю
1060-1320 МПа. Для получения заготовок и изделий из Б. в осн. используют
методы порошковой металлургии.
Б. в жидком состоянии раств. во мн. металлах, напр. в А1, Си, Fe, Co,
Ni, Zn, не раств. в Mg. Твердые р-ры образует лишь с нек-рыми металлами;
наиб, растворим Б. в сплавах с Си (2,75% по массе), N1 (2,7%), Сг (1,7%),
р-римость сильно уменьшается с понижением т-ры, в результате чего сплавы,
содержащие Б., способны к дисперсионному твердению.
Компактный Б. устойчив на воздухе и не взаимод. с горячей и холодной
водой благодаря образованию на его пов-сти пленки бериллия оксида
ВеО;
выше 800°С заметно окисляется. Взаимод. с разб. и конц. соляной к-той и
H2SO4, при нагревании-с HNO3. С р-рами
щелочей (с концентрированными-на холоду, с разбавленными-при нагревании)
образует соли - берилла ты М2[Ве(ОН)4], с расплавами
щелочей - бериллаты М2ВеО2. При взаимод. с N2
или
NH3 при 500-900°С получается нитрид Be3N2,
с С при 1700-2100°С - карбид Ве2С, с галогенами - галогениды
ВеНа12, с Р выше 750°С-фосфид Ве3Р2. В
вакууме выше 700°С Б. восстанавливает КОН, при 270°С - ВаО, при 1075°C
- MgO, при 1400°С - ТiO2 до соответствующих металлов и при 270°C
- SiCl4 до Si. С Н2 до 1300°С не взаимодействует.
Ниже приводятся св-ва нек-рых соед. Б.
Гидроксид Ве(ОН)2 получают осаждением из водных р-ров солей
Б. аммиаком или NaOH; в зависимости от условий осаждения гидроксид может
существовать в разл. формах, отличающихся структурой и р-римостью в воде.
Он амфотерен; свежеосажденный реагирует с к-тами, с р-рами щелочей образует
М2[Ве(ОН)4].
Из галогенидов Б. наиб, важен бериллия фторид
BeF2.
Для ВеС12 т. пл. 416°С, т. кип. 550°С; раств. в воде (42,2%
по массе при 20°С), спирте, эфире, CS2; получают действием С12
на смесь ВеО и С при 650-1000 °С; компонент расплавов при электролитич.
получении Б. Для ВеВr2 т. пл. 488 °С, для Ве12 510°С.
Сульфат BeSO4 и нитрат Be(NO3)2 при
обычных условиях существуют в виде тетрагидратов. Сульфат раств. в воде
(29,7% BeSO4 при 25°С); мало гигроскопичен: при 400°С обезвоживается,
при 547-600°С разлагается на ВеО и SO3. Нитрат раств. в воде
[51,2% Be(NO3)2 при 20 С]; сильно гигроскопичен;
при 60-100°С образует гидроксопитрат переменного состава, выше 200°С или
при 130-300°С в вакууме разлагается до ВеО; безводную соль получают разложением
Be(NO3)2*2N2O4 в вакууме при
50 oС.
Гидроксокарбонат - соед. переменного состава, образуется при взаимод.
водных р-ров солей Б. с Na2CO3 или (NH4)2CO3;
с др. карбонатами дает комплексные соединения.
Действием карбоновых к-т на Ве(ОН)2 или гидроксокарбонат
Б. получают оксисоли типа Be4O(OOCR)6, представляющие
собой молекулярные соединения. Наиб. важен оксиацетат Ве4О(ООССН3)6
-
кристаллы; т.пл. 284°С, т. кип. 331°С, т. возг. 200°С (в вакууме), т. разл.
600-700°С; не раств. в воде, хорошо раств. в орг. р-рителях; промежут.
продукт при очистке Б. от др. элементов перегонкой, а также при получении
ВеО высокой чистоты. Для формиата Ве4О(ООСН)6 т.
возг. 247-257°С (в вакууме). В водных р-рах соли Б. гидролизуются.
Получение. Б. извлекают из рудного концентрата (берилла) сульфатным
или фторидным способом. В первом случае концентрат сплавляют (750°С) с
Na2CO3 или СаСО3, сплав обрабатывают конц.
горячей H2SO4. Из образовавшегося р-ра сульфатов
Be, A1 и др. действием (NH4)2SO4 отделяют
А1 в виде алюмо-аммониевых квасцов, оставшийся р-р обрабатывают избытком
NaOH; при этом образуется р-р Na2[Be(OH)4] и алюминатов
Na. При кипячении р-ра в результате разложения бериллата осаждается Ве(ОН)2;
алюминат остается в р-ре; Ве(ОН)2 очищают от примесей экстракцией
трибутилфосфатом.
По фторидному способу концентрат спекают с Na2[SiF6]
и Na2CO3. Ок. 750°С образуется фторобериллат Na:
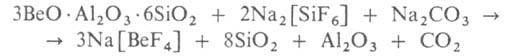
Фторобериллат Na2[BeF4] выщелачивают водой и из
полученного р-ра действием NaOH осаждают Ве(ОН)2, при прокаливании
к-рого образуется ВеО. Иногда Ве(ОН)2 дополнительно очищают,
растворяя его в H2SO4 в присут. комплексонов и затем
осаждая аммиаком. К оставшемуся после действия NaOH р-ру, содержащему NaF,
для утилизации последнего добавляют Fe2(SO4)3,
при этом осаждается Na3[FeF6], к-рый также используется
для разложения берилла, частично заменяя Na2[SiF6].
Сульфатный способ используют также для извлечения Б. из бертрандита.
При этом сернокислый р-р экстрагируют керосином, содержащим ди(2-этилгексил)
фосфорную к-ту. Орг. фракцию обрабатывают водным р-ром (NH4)2CO3,
при этом осаждаются гидроксиды и гидроксокарбонаты Fe и А1, а Б. остается
в р-ре в виде (NH4)2[Be(CO3)2],
к-рый при нагревании р-ра до 95°С количественно разлагается, образуя осадок
2ВеСО3*Ве(ОН)2; при прокаливании последнего при 165°С
получают Ве(ОН)2.
Для получения металлич. бериллия ВеО или Ве(ОН)2 переводят
в ВеС12 или BeF2. Фторид восстанавливают Mg при 925-1325°С.
Расплав смеси ВеС12 с NaCl подвергают электролизу. Очищают Б.
до 99,98%-ной чистоты вакуумной дистилляцией. Пластичный Б., содержащий
не более 10~4% примесей, получают зонной плавкой.
Определение. Для обнаружения Б. используют эмиссионные дуговой и искровой
спектральные методы (особенно широко - при анализе прир. и биол. объектов),
колориметрич. (с хинализарином, бериллоном II или арсеназо I), флуорометрич.
(с морином, 8-гидроксихинолином, 8-гидроксихинальдином) и радиоактивационные
методы. Важное значение имеет фотонейтронный метод, не требующий отделения
сопутствующих элементов; кол-во нейтронов, возникающих при р-ции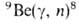 Be, пропорционально содержанию Б. в пробе. Для определения Б. в биол. объектах
и воде океанов практич. значение имеет метод изотопного разбавления с использованием
искусственного радиоактивного изотопа 7Ве(Т1/2 53,01
сут). Гравиметрич. методом Б. определяют: в виде ВеО, получаемого после
осаждения Ве(ОН)2 аммиаком при рН 9,6 в присут. комплексона
III и прокаливания при 1000°С; в виде Ве2Р2О7,
образующегося после осаждения и прокаливания при 800°С NH4BePO4;
в виде [Co(NH3)6]2[Be4O(CO3)6]*хН2О
(х = 10,8 - 11,3), осаждающегося при действии [Co(NH3)6]Cl2
на р-р (NH4)2[Be(CO3)2].
Be, пропорционально содержанию Б. в пробе. Для определения Б. в биол. объектах
и воде океанов практич. значение имеет метод изотопного разбавления с использованием
искусственного радиоактивного изотопа 7Ве(Т1/2 53,01
сут). Гравиметрич. методом Б. определяют: в виде ВеО, получаемого после
осаждения Ве(ОН)2 аммиаком при рН 9,6 в присут. комплексона
III и прокаливания при 1000°С; в виде Ве2Р2О7,
образующегося после осаждения и прокаливания при 800°С NH4BePO4;
в виде [Co(NH3)6]2[Be4O(CO3)6]*хН2О
(х = 10,8 - 11,3), осаждающегося при действии [Co(NH3)6]Cl2
на р-р (NH4)2[Be(CO3)2].
Применение. Б.-легирующая добавка в медных [бериллиевые бронзы; в США
- ок. 80% производимого Б. (1980)], никелевых, железных, магниевых и др.
сплавах, приобретающих благодаря Б. высокую прочность и твердость, хорошую
электрич. проводимость, теплопроводность и коррозионную стойкость. Насыщение
пов-сти стальных деталей Б. (бериллизация) повышает их коррозионную стойкость.
Ок. 20% производимого Б. (США, 1980) используется в авиастроении, ракетной
(детали сверхзвуковых самолетов. оболочки ракет и др.) и ядерной технике
(отражатели, замедлители нейтронов); ок. 40%-в электротехнике, ок. 15%-в
электронике (напр., приборы акустоэлектроники). Из Б. изготовляют окошки
рентгеновских трубок, т. к. он проницаем для рентгеновских лучей. Изотоп
7Ве
- радиоактивный индикатор. Б. в смеси с препаратами Ra служит источником
нейтронов (т.к. испускает нейтроны при действии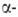 частиц,
частиц,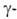 излучения)
и дейтронов в результате ядерных р-ций:
излучения)
и дейтронов в результате ядерных р-ций: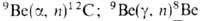 ; 9Be(d, n)10Be.
; 9Be(d, n)10Be.
Летучие и р-римые соед. Б., пыль, содержащая Б. и его соед., очень токсичны,
обладают аллергич. и канцерогенным действием, раздражают кожу и слизистые
оболочки, вызывают дерматозы, конъюнктивиты, назофарингит и др. заболевания
кожи и слизистых, заболевания легких и бронхов - трахеобронхит, пневмонию
и опухоли легких. Заболевания могут возникнуть через 10-15 лет после прекращения
контакта с Б. Для Б. и его соед. (в пересчете на Б.) ПДК 0,001 мг/м3,
в питьевой воде 0,0002 мг/л.
Мировая добыча бериллиевых руд 1350 т/год (1979), самого Б.-ок. 350
т/год (1980). Б. открыт Л. Вокленом в 1798. Металлич. Б. получен Ф. Вёлером [Велером]
и независимо от него А. Бюсси в 1828.
Лит.: Бериллий, под ред. Д.Уайта, Д. Берка, пер. с англ., М.,
1960; Дарвин Дж., БаддериДж., Бериллий, пер. с англ., М., 1962; Кьелл грен
Б. Р., Бериллий, в кн.: Справочник по редким металлам, пер. с англ., М.,
1965, с. 47-80; Новоселова А. В., Бацанова Л. Р., Аналитическая химия бериллия,
М., 1966; Эверест Д. А., Химия бериллия, пер. с англ., М., 1968; Котан
Б. И., Капустинская К. А., Топунова Г. А., Бериллий, М., 1975: Бериллий.
Справочник, под ред. А. И. Бурназяна, М., 1980; Beryllium science and technology,
ed. by D. Webster, G.J.London, v. 1-2, N.Y.-L.. 1979. A.B. Новоселова.

