БЕРКЛИЙ
(от Беркли, Berkeley - город в США, где был открыт Б.;
лат. Berkelium) Bk, искусственный радиоактивный хим. элемент III гр. периодич.
системы; ат. н. 97; относится к актиноидам. Стабильных изотопов
не имеет. Получены 10 изотопов с мае. ч, 240-251 (кроме 241). Наиб. долгоживущие:
247Bk
(Т1/2 1380 лет;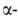 излучатель);
249Bk
(Т1/2 314 сут;
излучатель);
249Bk
(Т1/2 314 сут;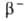 -излучатель). Конфигурация внеш. электронных оболочек атома 5f86s26p6d17s2;
степени окисления +3 (наиб. устойчива), Ч-4; энергия ионизации Bk° -> Bk3+
40,8 эВ; электроотрицательность по Полингу 1,0-1,2; ионные радиусы Bk3+
0,0935 нм, Bk4+ 0,0870 нм.
-излучатель). Конфигурация внеш. электронных оболочек атома 5f86s26p6d17s2;
степени окисления +3 (наиб. устойчива), Ч-4; энергия ионизации Bk° -> Bk3+
40,8 эВ; электроотрицательность по Полингу 1,0-1,2; ионные радиусы Bk3+
0,0935 нм, Bk4+ 0,0870 нм.
Б. - серебристо-белый металл. Существует в двух модификациях: с гранецентрированной
кубич. решеткой (a = = 0,4997 нм) и двойной гексагональной типа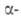 La
(a — = 0,3416 нм, с = 1,1069 нм, z = 2); т-ра полиморфного перехода
ок. 980°С; т. пл. ок. 1050°С, т. кип. ок. 2630°С; плотн. 14,8 г/см3.
Св-ва изучались с использованием микрограммовых кол-в
249Bk.
La
(a — = 0,3416 нм, с = 1,1069 нм, z = 2); т-ра полиморфного перехода
ок. 980°С; т. пл. ок. 1050°С, т. кип. ок. 2630°С; плотн. 14,8 г/см3.
Св-ва изучались с использованием микрограммовых кол-в
249Bk.
Б. очень реакционноспособен, по хим. св-вам близок к Тb. Диоксид BkO2
(кубич. решетка) получают сжиганием на воздухе при 1250°С ионита, на к-ром
сорбированы ионы Bk3+ . При восстановлении BkO2 водородом
при
600°С образуется сесквиоксид Bk2O3 (кубич. решетка),
при нагревании и послед, быстром охлаждении образуется гексагон. модификация.
На воздухе при 600°С Bk2O3 окисляется до ВkO2.
Тригалогениды BkHal3 (см. табл.) получают взаимод. Bk2O3
с HHal при 500-600°С, тетрафториД BkF4 -фторированием Bk2O3
элементным фтором при 400°С; синтезированы также оксогалогениды ВkOС1 и
BkOBr.
Сульфид получают по р-ции: Bk2O3 + CS2
+ H2S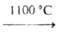 Bk2S3 + CO2 + H2O. Известны
также гидроксид Bk(OH)3, сульфидоксид Bk2O2S2,
нитрид BkN, фосфид BkP, арсенид BkAs, гидриды ВkH2+x. (х <
1) и нек-рые орг. производные. В расплавах Bk3 +
способен восстанавливаться до Bk2+.
Bk2S3 + CO2 + H2O. Известны
также гидроксид Bk(OH)3, сульфидоксид Bk2O2S2,
нитрид BkN, фосфид BkP, арсенид BkAs, гидриды ВkH2+x. (х <
1) и нек-рые орг. производные. В расплавах Bk3 +
способен восстанавливаться до Bk2+.
СВОЙСТВА ГАЛОГЕНИДОВ БЕРКЛИЯ
|
Соединение
|
Цвет
|
Кристалл ич. решетка
|
Параметры решетки, нм
|
|
а
|
Ь
|
с
|
|
BkF3
|
Желто-зеленый
|
Орторомбич.,
|
0,670
|
0,709
|
0,441
|
|
гексаген.
|
0,697
|
—
|
0,714
|
|
BkCl3
|
Зеленый
|
Гексагон.
|
0,7382
|
—
|
0,4127
|
|
BkBr3
|
Желто-зеленый
|
Орторомбич.
|
0,1260
|
0,4100
|
0,9100
|
|
BkI3
|
Желтый
|
Гексагон.
|
0,750
|
—
|
0,204
|
|
BkF4
|
Светло-коричневый
|
Орторомбич.
|
0,1247
|
0,1058
|
0,8170
|
Нитраты, хлориды, бромиды, сульфаты, перхлораты и сульфиды Б. раств.
в воде. В водных р-рах Б. существует в виде ионов Bk3 +
и Bk4 + . Для Bk3 +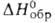 -712 кДж/моль,
-712 кДж/моль,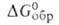 -699 кДж/моль, So298 170 Дж/(моль*), энтальпия и
энтропия гидратации соотв. —49,2 кДж/моль и 369 Дж/(моль*К). Стандартный
электродный потенциал Bk°/Bk3+ 2,4В, пары Bk3+/Bk4+
-1,62 В. Из водных р-ров Bk3+ соосаждается с LaF3
и La(OH)3. Ион Bk4+ м. б. получен окислением Bk3+
в кислой среде висмутатом Na, KBrO3, O3, AgO, (NH4)2S2O8
или его смесью с AgNO3, K2Cr2O7,
PbO2, Na4XeO6, а также электрохим. окислением.
Из р-ра Bk4+ м. б. выделен соосаждением с фосфатом Zr или Се(IO3)4.
-699 кДж/моль, So298 170 Дж/(моль*), энтальпия и
энтропия гидратации соотв. —49,2 кДж/моль и 369 Дж/(моль*К). Стандартный
электродный потенциал Bk°/Bk3+ 2,4В, пары Bk3+/Bk4+
-1,62 В. Из водных р-ров Bk3+ соосаждается с LaF3
и La(OH)3. Ион Bk4+ м. б. получен окислением Bk3+
в кислой среде висмутатом Na, KBrO3, O3, AgO, (NH4)2S2O8
или его смесью с AgNO3, K2Cr2O7,
PbO2, Na4XeO6, а также электрохим. окислением.
Из р-ра Bk4+ м. б. выделен соосаждением с фосфатом Zr или Се(IO3)4.
Б. образует более прочные, чем РЗЭ, комплексы с С1-. На способности
Bk3+ к комплексообразованию, напр. с NCS- или цитрат-ионами,
основано его отделение от др. актиноидов и РЗЭ. Так, Bk3+ экстрагируется
бензолом в виде внутрикомплексного соединения с теноилтрифторацетоном при
рН 4 в 10-15 раз эффективнее, чем Аm3+ и Ст3+.
Изотоп 249Bk образуется в ядерных реакторах при длительном
интенсивном облучении нейтронами плутониевых или кюриевых мишеней в результате
многократного захвата нейтронов. Этим путем в США получают ок. 20 мг 249Bk
в год. Изотоп 247Bk образуется при бомбардировке кюриевых мишеней частицами,
ускоренными на циклотроне. Выделение Б. из материалов облученных мишеней
включает: отделение Am; осаждение Cm, Bk, РЗЭ, Pu и остаточного кол-ва
Am в виде фторидов; превращение фторидов в гидроксиды; растворение и перевод
гидроксидов в хлораты; хроматографич. разделение хлоратов на катионите
с использованием в кач-ве элюентов р-ров цитрата аммония, молочной или
частицами,
ускоренными на циклотроне. Выделение Б. из материалов облученных мишеней
включает: отделение Am; осаждение Cm, Bk, РЗЭ, Pu и остаточного кол-ва
Am в виде фторидов; превращение фторидов в гидроксиды; растворение и перевод
гидроксидов в хлораты; хроматографич. разделение хлоратов на катионите
с использованием в кач-ве элюентов р-ров цитрата аммония, молочной или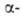 гидроксиизомасляной
к-т. Применяют метод, включающий растворение гидроксидов в HNO3
и перевод Bk3+ в Bk4+ с одноврем. жидкостной экстракцией
его трибутилфосфатом, что позволяет отделить Б. от лантаноидов и др. актиноидов
в степени окисления + 3. Реэкстракцией р-ром (N2H5)C1
или (NH3OH)C1 получают продукт, содержащий 92% Bk и 8% Am. Транскюриевые
элементы м. б. отделены от Pu, Am и Cm экстракцией их из разб. солянокислых
р-ров р-ром 2-этилгексилфенилфосфорной к-ты в диэтилбензоле. При реэкстракции
разбавленной соляной к-той количественно разделяются Bk и Cf.
гидроксиизомасляной
к-т. Применяют метод, включающий растворение гидроксидов в HNO3
и перевод Bk3+ в Bk4+ с одноврем. жидкостной экстракцией
его трибутилфосфатом, что позволяет отделить Б. от лантаноидов и др. актиноидов
в степени окисления + 3. Реэкстракцией р-ром (N2H5)C1
или (NH3OH)C1 получают продукт, содержащий 92% Bk и 8% Am. Транскюриевые
элементы м. б. отделены от Pu, Am и Cm экстракцией их из разб. солянокислых
р-ров р-ром 2-этилгексилфенилфосфорной к-ты в диэтилбензоле. При реэкстракции
разбавленной соляной к-той количественно разделяются Bk и Cf.
В малых кол-вах 249Bk определяют радиометрич. методом - измерением
общей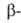 активности
препарата после полной хим. и радиохим. очистки. Сравнительно большие кол-ва
Б. могут быть определены измерением его
активности
препарата после полной хим. и радиохим. очистки. Сравнительно большие кол-ва
Б. могут быть определены измерением его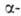 активности
(с энергией 5,46 МэВ). Перспективны спектрофотометрич. методы определения
с использованием орг. реагентов.
активности
(с энергией 5,46 МэВ). Перспективны спектрофотометрич. методы определения
с использованием орг. реагентов.
Изотопы Б. применяют для исследовательских работ в ядерной физике и
радиохимии.
Б. синтезирован С. Томпсоном, А. Гиорсо и Г. Сиборгом в 1949 бомбардировкой
241Аm2О3
высокоэнергетич. ионами Не [241 Am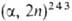 Bk]. Изотоп
243Bk в кол-ве ок. 0,4 мкг был получен Б. Каннингемом
и С. Томпсоном в 1958. В виде металла Б. получили Дж. Петерсон, Дж. А.
Фейни и С. Д. Бейларц только в 1970 путем восстановления BkF3 парами
Li в тигле из тантала при 1000-1050 °С в глубоком вакууме.
Bk]. Изотоп
243Bk в кол-ве ок. 0,4 мкг был получен Б. Каннингемом
и С. Томпсоном в 1958. В виде металла Б. получили Дж. Петерсон, Дж. А.
Фейни и С. Д. Бейларц только в 1970 путем восстановления BkF3 парами
Li в тигле из тантала при 1000-1050 °С в глубоком вакууме.
Лит. см. пру ст. Актиноиды
. Б. В. Громов.



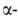 излучатель);
249Bk
(Т1/2 314 сут;
излучатель);
249Bk
(Т1/2 314 сут;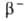 -излучатель). Конфигурация внеш. электронных оболочек атома 5f86s26p6d17s2;
степени окисления +3 (наиб. устойчива), Ч-4; энергия ионизации Bk° -> Bk3+
40,8 эВ; электроотрицательность по Полингу 1,0-1,2; ионные радиусы Bk3+
0,0935 нм, Bk4+ 0,0870 нм.
-излучатель). Конфигурация внеш. электронных оболочек атома 5f86s26p6d17s2;
степени окисления +3 (наиб. устойчива), Ч-4; энергия ионизации Bk° -> Bk3+
40,8 эВ; электроотрицательность по Полингу 1,0-1,2; ионные радиусы Bk3+
0,0935 нм, Bk4+ 0,0870 нм.
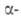 La
(a — = 0,3416 нм, с = 1,1069 нм, z = 2); т-ра полиморфного перехода
ок. 980°С; т. пл. ок. 1050°С, т. кип. ок. 2630°С; плотн. 14,8 г/см3.
Св-ва изучались с использованием микрограммовых кол-в
249Bk.
La
(a — = 0,3416 нм, с = 1,1069 нм, z = 2); т-ра полиморфного перехода
ок. 980°С; т. пл. ок. 1050°С, т. кип. ок. 2630°С; плотн. 14,8 г/см3.
Св-ва изучались с использованием микрограммовых кол-в
249Bk.
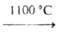 Bk2S3 + CO2 + H2O. Известны
также гидроксид Bk(OH)3, сульфидоксид Bk2O2S2,
нитрид BkN, фосфид BkP, арсенид BkAs, гидриды ВkH2+x. (х <
1) и нек-рые орг. производные. В расплавах Bk3 +
способен восстанавливаться до Bk2+.
Bk2S3 + CO2 + H2O. Известны
также гидроксид Bk(OH)3, сульфидоксид Bk2O2S2,
нитрид BkN, фосфид BkP, арсенид BkAs, гидриды ВkH2+x. (х <
1) и нек-рые орг. производные. В расплавах Bk3 +
способен восстанавливаться до Bk2+.
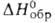 -712 кДж/моль,
-712 кДж/моль,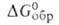 -699 кДж/моль, So298 170 Дж/(моль*), энтальпия и
энтропия гидратации соотв. —49,2 кДж/моль и 369 Дж/(моль*К). Стандартный
электродный потенциал Bk°/Bk3+ 2,4В, пары Bk3+/Bk4+
-1,62 В. Из водных р-ров Bk3+ соосаждается с LaF3
и La(OH)3. Ион Bk4+ м. б. получен окислением Bk3+
в кислой среде висмутатом Na, KBrO3, O3, AgO, (NH4)2S2O8
или его смесью с AgNO3, K2Cr2O7,
PbO2, Na4XeO6, а также электрохим. окислением.
Из р-ра Bk4+ м. б. выделен соосаждением с фосфатом Zr или Се(IO3)4.
-699 кДж/моль, So298 170 Дж/(моль*), энтальпия и
энтропия гидратации соотв. —49,2 кДж/моль и 369 Дж/(моль*К). Стандартный
электродный потенциал Bk°/Bk3+ 2,4В, пары Bk3+/Bk4+
-1,62 В. Из водных р-ров Bk3+ соосаждается с LaF3
и La(OH)3. Ион Bk4+ м. б. получен окислением Bk3+
в кислой среде висмутатом Na, KBrO3, O3, AgO, (NH4)2S2O8
или его смесью с AgNO3, K2Cr2O7,
PbO2, Na4XeO6, а также электрохим. окислением.
Из р-ра Bk4+ м. б. выделен соосаждением с фосфатом Zr или Се(IO3)4.
 частицами,
ускоренными на циклотроне. Выделение Б. из материалов облученных мишеней
включает: отделение Am; осаждение Cm, Bk, РЗЭ, Pu и остаточного кол-ва
Am в виде фторидов; превращение фторидов в гидроксиды; растворение и перевод
гидроксидов в хлораты; хроматографич. разделение хлоратов на катионите
с использованием в кач-ве элюентов р-ров цитрата аммония, молочной или
частицами,
ускоренными на циклотроне. Выделение Б. из материалов облученных мишеней
включает: отделение Am; осаждение Cm, Bk, РЗЭ, Pu и остаточного кол-ва
Am в виде фторидов; превращение фторидов в гидроксиды; растворение и перевод
гидроксидов в хлораты; хроматографич. разделение хлоратов на катионите
с использованием в кач-ве элюентов р-ров цитрата аммония, молочной или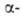 гидроксиизомасляной
к-т. Применяют метод, включающий растворение гидроксидов в HNO3
и перевод Bk3+ в Bk4+ с одноврем. жидкостной экстракцией
его трибутилфосфатом, что позволяет отделить Б. от лантаноидов и др. актиноидов
в степени окисления + 3. Реэкстракцией р-ром (N2H5)C1
или (NH3OH)C1 получают продукт, содержащий 92% Bk и 8% Am. Транскюриевые
элементы м. б. отделены от Pu, Am и Cm экстракцией их из разб. солянокислых
р-ров р-ром 2-этилгексилфенилфосфорной к-ты в диэтилбензоле. При реэкстракции
разбавленной соляной к-той количественно разделяются Bk и Cf.
гидроксиизомасляной
к-т. Применяют метод, включающий растворение гидроксидов в HNO3
и перевод Bk3+ в Bk4+ с одноврем. жидкостной экстракцией
его трибутилфосфатом, что позволяет отделить Б. от лантаноидов и др. актиноидов
в степени окисления + 3. Реэкстракцией р-ром (N2H5)C1
или (NH3OH)C1 получают продукт, содержащий 92% Bk и 8% Am. Транскюриевые
элементы м. б. отделены от Pu, Am и Cm экстракцией их из разб. солянокислых
р-ров р-ром 2-этилгексилфенилфосфорной к-ты в диэтилбензоле. При реэкстракции
разбавленной соляной к-той количественно разделяются Bk и Cf.
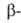 активности
препарата после полной хим. и радиохим. очистки. Сравнительно большие кол-ва
Б. могут быть определены измерением его
активности
препарата после полной хим. и радиохим. очистки. Сравнительно большие кол-ва
Б. могут быть определены измерением его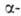 активности
(с энергией 5,46 МэВ). Перспективны спектрофотометрич. методы определения
с использованием орг. реагентов.
активности
(с энергией 5,46 МэВ). Перспективны спектрофотометрич. методы определения
с использованием орг. реагентов.
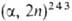 Bk]. Изотоп
243Bk в кол-ве ок. 0,4 мкг был получен Б. Каннингемом
и С. Томпсоном в 1958. В виде металла Б. получили Дж. Петерсон, Дж. А.
Фейни и С. Д. Бейларц только в 1970 путем восстановления BkF3 парами
Li в тигле из тантала при 1000-1050 °С в глубоком вакууме.
Bk]. Изотоп
243Bk в кол-ве ок. 0,4 мкг был получен Б. Каннингемом
и С. Томпсоном в 1958. В виде металла Б. получили Дж. Петерсон, Дж. А.
Фейни и С. Д. Бейларц только в 1970 путем восстановления BkF3 парами
Li в тигле из тантала при 1000-1050 °С в глубоком вакууме.