БУФЕРНЫЙ РАСТВОР
, поддерживает при изменении состава среды постоянство
значения к.-л. характеристики, напр. рН (кислотно-основной Б. р.) или окислит.-восстановит.
потенциала (окислит.-восстановит. Б. р.).
Значение рН кислотно-основного Б. р. зависит от концентраций компонентов
буферной смеси, находящихся в хим. равновесии, и мало меняется при концентрировании
и разбавлении р-ра, введении относительно небольших кол-в в-в, взаимодействующих
с одним из компонентов буферного раствора.
Наиб. распространены водные кислотно-основные Б. р. Они содержат слабую
к-ту НА и сопряженное с ней основание А -, напр. СН3СООН и СН3СОО-,
NH4+ и NH3. В таких системах осуществляется
равновесие:
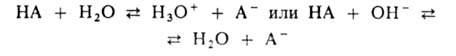
По данным о константе диссоциации к-ты Ка = — [Н3О+]
[А- ] /[НА] определяют значение рН р-ра:
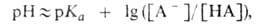
где [НА] и [А-] -равновесные концентрации соотв. к-ты и основания,
рКа= —lgКа. Это значение рН остается практически постоянным,
т.к. при добавлении небольших кол-в сильных к-т или оснований ионы Н3О+
или ОН-связываются основанием (к-той) с образованием сопряженной
к-ты (основания).
Количественно Б. р. характеризуется буферной емкостью- производной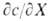 , где X - характеристика среды, с - концентрация одного из компонентов
буферной смеси или добавленного в-ва, количественно реагирующего с одним
из компонентов с образованием другого.
, где X - характеристика среды, с - концентрация одного из компонентов
буферной смеси или добавленного в-ва, количественно реагирующего с одним
из компонентов с образованием другого.
Емкость кислотно-основного Б. р. соответствует числу эквивалентов сильной
к-ты или сильного основания, к-рое необходимо добавить к 1 л р-ра, чтобы
изменить его рН на единицу. Буферная емкость возрастает при увеличении
начальных концентраций его компонентов и максимальна при их равенстве.
Буферные св-ва проявляются очень слабо, если концентрация одного компонента
в 10 раз и более отличается от концентрации другого. Поэтому Б. р. часто
готовят смешением р-ров равной концентрации обоих компонентов либо прибавлением
к р-ру одного компонента соответствующего кол-ва реагента, приводящего
к образованию равной концентрации сопряженной формы.
Интервал рН (равный обычно рКа ± 1), в к-ром данная
буферная система может поддерживать постоянное значение рН, наз. областью
буферирования. В справочной литературе имеются подробные рецепты приготовления
кислотно-основных Б. р. для разл. значений рН.
Окислит.-восстановит. Б. р. содержит смесь соед. элементов переменной
валентности в двух степенях окисления (т. е. смесь обеих форм окислит.-восстановит.
пары), напр. Fe(III) и Fe(II). Значение окислит.-восстановит. потенциала
такого Б. р. определяется по ф-ле:
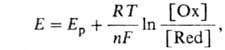
где Ер- реальный потенциал пары в данной среде, [Ох] и [Red]-концентрации
соотв. ее окисленной и восстановленной форм, n - число электронов, участвующих
в окислит.-восстановит. р-ции, R - универсальная газовая постоянная, F- число
Фарадея, T - абс. т-ра.
В методах фотометрии пламени (в т.ч. в атомно-абсорбционном анализе)
буферными называют р-ры, поддерживающие практически постоянное значение
характеристики не самого р-ра, а пламени, в к-рое они вдуваются. Напр.,
такие легкоионизирующиеся в-ва, как соли К, обеспечивают концентрацию электронов
в пламени, необходимую для подавления ионизации определяемых атомов. В
электрохим. методах анализа буферным иногда называют р-р, препятствующий
смешению р-ров вблизи анода и катода.
Многие биол. жидкости (кровь и др.) являются Б. р.; компоненты таких
р-ров - карбонаты, фосфаты и белки.
Лит.: Шарло Г., Методы аналитической химии. Количественный анализ
неорганических соединений, пер. с франц., МЛ., 1966; Руководство по аналитической
химии, пер. с нем., М., 1975; Лурье Ю. Ю., Справочник по аналитической
химии, 5 изд., М., 1979, с. 305-12. Б. Я. Каплан.

