ЦЕЗИЙ
[от лат. caesius - голубой
(по ярко-синим спектр. линиям); лат. Cesium] Cs, хим. элемент I гр. периодич.
системы, ат. н. 55, ат. м. 132,9054; относится к щелочным металлам.
Природный
Ц. состоит из стабильного нуклида 133Cs. Поперечное сечение
захвата тепловых нейтронов 2,9 х 10-27 м2. Конфигурация
внеш. электронной оболочки атома 6s1; степень окисления
+1; энергия ионизации при переходе Cs° Cs+
Cs+ Cs2+
соотв. 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность
по Полингу 0,7; работа выхода электрона 1,81 эВ; металлич. радиус 0,266
нм, кова-лентный радиус 0,235 нм, ионный радиус Cs+ 0,181 нм
(координац. число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202
нм (12).
Cs2+
соотв. 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность
по Полингу 0,7; работа выхода электрона 1,81 эВ; металлич. радиус 0,266
нм, кова-лентный радиус 0,235 нм, ионный радиус Cs+ 0,181 нм
(координац. число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202
нм (12).
Содержание Ц. в земной коре 3,7 x 10-4%
по массе. Минералы Ц.- поллуцит (Cs, Na)[AlSi2O6]
x nН2О (содержание Cs2O 29,8-36,7% по массе)
и редкий авогадрит (К, Cs)[BF4]. Ц. присутствует в виде примеси
в богатых калием алюмосиликатах: лепидолите (0,1-0,5% Cs2O),
флогопите (0,2-1,5%) и др., также в карналлите (0,0003-0,002% CsCl), трифилине,
в термальных (до 5 мг/л Cs) и озерных (до 0,3 мг/л Cs) водах. Пром. источники
Ц.- поллуцит и лепидолит. Осн. месторождения поллуцита находятся в Канаде,
Намибии, Зимбабве. Перспективные сырьевые источники: нефелиновые руды,
карналлит, цезиевый биотит, флогопит и др. слюды и слюдяные хвосты, получаемые
при разработке берилловых, фенакитовых, флюоритовых месторождений, а также
высокоминерализованные термальные воды.
Свойства. Ц.- мягкий серебристо-белый
металл, при комнатной т-ре находится в полужидком состоянии. Пары окрашены
в зеленовато-синий цвет. Кристаллизуется в кубич. объемноцентрированной
решетке: а = 0,6141 нм, z = 2, пространств. группа Im3m;
т. пл. 28,44 °С, т. кип. 669,2 °С; плотн. 1,904 г/см3 (20 °С);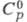 32,21 Дж/(моль x К);
32,21 Дж/(моль x К);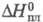 2,096 кДж/моль,
2,096 кДж/моль,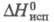 65,62 кДж/моль,
65,62 кДж/моль, 76,54 кДж/моль (298,15 К);
76,54 кДж/моль (298,15 К);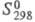 85,23 Дж/(моль x К); ур-ния температурной зависимости давления пара: lgp
(мм рт. ст.) = -4122/T+ 5,228 - 1,514 lgT + 3977T
(100-301,59 К), lgp (мм рт. ст.)= -3822/T + 4,940 - 0,746
lgТ (301,59-897 К); теплопроводность, Вт/(м x К): 19,0 (298 К),
19,3 (373 К), 20,2 (473 К);
85,23 Дж/(моль x К); ур-ния температурной зависимости давления пара: lgp
(мм рт. ст.) = -4122/T+ 5,228 - 1,514 lgT + 3977T
(100-301,59 К), lgp (мм рт. ст.)= -3822/T + 4,940 - 0,746
lgТ (301,59-897 К); теплопроводность, Вт/(м x К): 19,0 (298 К),
19,3 (373 К), 20,2 (473 К);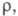 мкОм x м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59
К, жидкость), температурный коэф.
мкОм x м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59
К, жидкость), температурный коэф.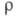 6,0 x 10-3 К-1 (273-291 К); парамагнетик, уд. магн.
восприимчивость +0,22 x 10-9 (293 К);
6,0 x 10-3 К-1 (273-291 К); парамагнетик, уд. магн.
восприимчивость +0,22 x 10-9 (293 К);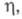 мПа x с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К);
мПа x с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К);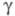 60,6 мН/м (301,59 К); температурный коэф. линейного расширения 97 x 10-6
К-1 (273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа
(293 К); коэф. сжимаемости 71 x 10-11Па-1 (323 К).
60,6 мН/м (301,59 К); температурный коэф. линейного расширения 97 x 10-6
К-1 (273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа
(293 К); коэф. сжимаемости 71 x 10-11Па-1 (323 К).
По чувствительности к свету Ц. превосходит
все др. элементы. Катод из Ц. испускает поток электронов даже под действием
ИК излучения с длиной волны 0,80 мкм, макс. электронная эмиссия наблюдается
у Ц. при освещении зеленым светом (у др. элементов - при действии фиолетовых
или УФ лучей).
Ц. химически очень активен. Стандартный
электродный потенциал -2,923 В. На воздухе мгновенно окисляется с воспламенением,
образуя надпероксид CsO2 с примесью пероксида Cs2O2.
При ограниченном доступе О2 окисляется до цезия оксида
Cs2O;
CsO2 переходит в озонид CsO3 в токе озонированного
О2 при 40 °С. С водой Ц. реагирует со взрывом с образованием
гидроксида CsOH и выделением Н2. Взаимод. с сухим Н2
при 200-350 °С под давлением 5-10 МПа или в присут. катализатора с образованием
гидрида CsH. Горит в атмосфере галогенов, давая цезия галогениды
. Сульфиды
Cs2Sn (n = 1-6) получают взаимод. металла
с S в жидком NH3. Селенид Cs2Se и теллурид Cs2Te
синтезируют сплавлением Ц. соотв. с Se и Те в вакууме. С N2
в обычных условиях Ц. не взаимод., с жидким N2 при электрич.
разряде между электродами, изготовленными из Ц., образует нитрид Cs3N.
Ц. раств. в жидком NH3, алкиламинах и полиэфирах, образуя синие
р-ры, обладающие электронной проводимостью; в аммиачном р-ре Ц. медленно
реагирует с NH3 c выделением Н2 и образованием амида
CsNH2. С газообразным NH3 при 120 °С образует CsNH2,
с красным Р в вакууме при 400-430 °С - фосфид Cs2P5,
с порошком графита при 200-500 °С- карбид C8Cs, а при более
высоких т-рах - C24Cs, C36Cs и др. карбиды, с ацетиленом
при 300 °С в вакууме - ацетиленид Cs2С2, с Si и Ge
в атмосфере Аr при 600 °С - соотв. силицид CsSi и германид CsGe. Ц. взаимод.
с СО2, ССl4 со взрывом. Выше 300 °С разрушает стекло,
восстанавливая Si из SiO2 и силикатов. Ц. реагирует со всеми
к-тами с образованием соответствующих солей, со спиртами дает алкоголяты.
Св-ва соед. Ц. представлены в табл.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ СОЕДИНЕНИЙ
ЦЕЗИЯ
|
Показатель
|
CsH
|
СsO3
|
CsOH
|
Cs2SO4
|
CsNO3
|
Cs2CO3
|
CsN3
|
|
Цвет
|
Бесцв.
|
Оранжево-красный
|
Бесцв.
|
Бесцв.
|
Бесцв.
|
Бесцв.
|
Желтоватый
|
|
Сингония
|
Кубич.
|
Тетрагон.
|
Ромбич.
|
Кубич.
|
Ромбич.
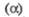
|
Гексагон.
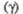
|
Гексагон.
|
—
|
Тетрагон.
|
Кубич.
|
|
Т. пл., °С
|
528
|
82а
|
224е
|
343
|
647б
|
1015
|
154е
|
793
|
151*
|
326
|
|
Плота. (25 oС),
г/см3
|
3,42
|
3,19
|
3,675 (11 °С)
|
—
|
4,246 (20 °С)
|
—
|
3,643 (20 °С)
|
_
|
_
|
|
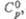
Дж/(моль x К) |
40,6
|
83,7
|
73
|
—
|
134,9
|
—
|
96,1
|
123,9
|
83 ,23
|
—
|
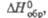
кДж/моль |
-54,0
|
-271,1
|
-416,6
|
7,1
|
-1442,9
|
—
|
-505,0
|
-1134,9
|
-19,6
|
3,22в
|
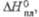
кДж/моль |
15
|
—
|
—
|
7,3
|
—
|
35,1
|
—
|
31
|
—
|
—
|
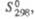
Дж/(моль К) |
73
|
134
|
102,6
|
—
|
211,9
|
—
|
153,8
|
204,5
|
134,4
|
—
|
|
Р-римость в воде,
г в 100 г
|
Разлагается с
вьщеле-нием Н2
|
Разлагается с
выделением О2
|
385,6 (15 °С)
303 (30 °С)
|
|
178,7 (20 °С)
210,3 (80 °С)
|
|
23,0 (20 °С) 134
(80 °С)
|
308,3 (20 °С)
|
224,2 (0 оС)
307,4 (16 °С)
|
|
а Т-ра разложения.
бТ-ра
полиморфного перехода. в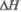 полиморфного перехода.
полиморфного перехода.
Ц. образует твердые р-ры с К и Rb, эвтектич.
смесь с Na, не смешивается с Li. Со мн. металлами дает интерметаллиды,
напр. CsAu, CsSn4.
Получение. Для извлечения Ц. из поллуцита
используют след. методы: кислотные, спекание и сплавление, прямое получение
металлич. Ц. В кислотных методах применяют галогеноводородные к-ты (чаще
соляную) или H2SO4. Поллуцит разлагают конц. соляной
к-той при натр., из полученного р-ра действием SbCl3 осаждают
Cs3[Sb2Cl9], к-рый обрабатывают горячей
водой или р-ром NH3 с образованием CsCl. При разложении поллуцита
серной к-той получают алюмоцезиевые квасцы CsAl(SO4)2
x
12H2O.
Из методов спекания и сплавления наиб.
распространен метод Аренда: поллуцит спекают со смесью СаО и СаС12,
спек выщелачивают в автоклаве горячей водой, р-р упаривают досуха с H2SO4
для отделения CaSO4, остаток обрабатывают горячей водой; из
полученного р-ра осаждают Cs3[Sb2Cl9].
Прямое извлечение металлич. Ц. осуществляют путем нагревания до 900 °С
в вакууме смеси (1:3) измельченного поллуцита и Са (или Аl).
Ц. из лепидолита получают попутно при
его переработке на соед. лития. Ц. осаждают из маточных р-ров после выделения
Li2CO3 или LiOH в виде смеси алюмоцезиевых, алюморубидиевых
и алюмокалиевых квасцов.
Для разделения Cs, Rb и К и получения
чистых соед. Ц. применяют методы фракционированной кристаллизации квасцов
и нитратов, осаждения и перекристаллизации Cs3[Sb2Cl9],
Cs2[SnCl6]. Используют также ионообменную хроматографию
на синтетич. смолах и неорг. ионитах (клиноптилолит и др.), экстракцию
производными фенола [4-втор
-бутил-2-(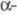 метилбензил)фенол,
алкилфенолы С7-С9 и др.]. Для получения соед. Ц.
высокой чистоты применяют его полигалогениды.
метилбензил)фенол,
алкилфенолы С7-С9 и др.]. Для получения соед. Ц.
высокой чистоты применяют его полигалогениды.
Извлечение радиоактивного изотопа 137Cs
(Т1/2 33 г, продукт деления U в ядерных реакторах) из
р-ров, полученных при переработке радиоактивных отходов ядерных реакторов,
осуществляют методами соосаждения с гексацианоферратами Fe, Ni, Zn или
фосфоровольфраматом аммония, ионного обмена на гексацианоферрате Ni, фосфоровольфрамате
аммония и др., экстракционным.
Металлич. Ц. получают в осн. металлотермии,
восстановлением CsCl (кальцием или магнием, 0,1-10 Па, 700-800 °С) с послед.
очисткой от примесей ректификацией и вакуумной дистилляцией. По др. способу
проводят электролиз расплава CsHal с жидким свинцовым катодом и получают
сплав Cs-Pb, из к-рого выделяют металлич. Ц. дистилляцией в вакууме. Ц.
высокой чистоты получают медленным термич. разложением CsN3
в вакууме (менее 10 Па, 390-395 °С).
Определение. Качественно Ц. обнаруживают
по характерным линиям спектра 894,35 нм и 852,11 нм. Для микрохим. обнаружения
используют осаждение Cs3[Sb2Cl9], Cs3[Bi2I9],
Cs[SnI5] и др. менее избирательные р-ции. Наиб. распространенные
методы определения микроколичеств Ц.- эмиссионная пламенная фотометрия
и атомно-абсорбционная спектрометрия. Применяют также радиохим. метод изотопного
разбавления и нейтронно-активационный анализ.
При высоком содержании Ц. в пробе его
определяют гравиметрически в виде Cs[B(C6H5)4],
Cs[Bi2I9,], Cs2[TeI6], Cs3[Co(NO2)6]
и нек-рых др. солей. В гораздо меньшей степени используют титриметрич.
и спектрофотометрич. методы.
Применение. Металлич. Ц.- компонент материала
катодов для фотоэлементов, фотоэлектронных умножителей, телевизионных передающих
электронно-лучевых трубок, термоэмиссионных электронно-оптич. преобразователей.
Ц. используют в вакуумных электронных приборах (как геттер), выпрямителях,
атомных стандартах времени. Цезиевые "атомные часы" необыкновенно точны.
Их действие основано на переходах между двумя состояниями атома Ц.- с параллельной
и антипараллельной ориентацией собств. магн. моментов ядра атома и валентного
электрона; этот переход сопровождается колебаниями со строго постоянными
характеристиками (длина волны 3,26 см). Пары Ц.- рабочее тело в магнитогидродинамич.
генераторах, газовых лазерах, ионных ракетных двигателях. Радионуклид 137Cs
используют для g-дефектоскопии,
в медицине для диагностики и лечения. Ц.-теплоноситель в ядерных реакторах,
компонент смазочных материалов для космич. техники.
Мировое произ-во Ц. и его соединений (без
СНГ) ок. 10 т в год.
Хранят Ц. в ампулах из стекла пирекс в
атмосфере Аr или стальных герметичных сосудах под слоем обезвоженного масла
(вазелинового, парафинового). Утилизируют обработкой остатков металла пентанолом.
СВОЙСТВА ГАЛОГЕНИДОВ ЦЕЗИЯ
|
Показатель
|
СsF
|
CsHF2
|
CsCl
|
CsBr
|
CsI
|
|
|
Сингония
|
Кубич.а
|
Тетрагон.
|
Кубич.
|
Кубич.
|
Кубич.
|
Кубич.
|
Кубич.
|
Кубич.
|
Кубич.
|
Кубич.
|
|
|
Параметр кристаллич.
решетки а, нм
|
0,601
|
0,614б
|
0,412
|
—
|
0,411
|
0,694
|
0,429
|
0,723
|
0,457
|
0,766
|
|
|
Число формульных
единиц в ячейке
|
4
|
—
|
1
|
—
|
1
|
4
|
1
|
4
|
1
|
4
|
|
|
Пространств.
группа
|
FтЗт
|
I4/тст
|
Рт3т
|
_
|
Рт3т
|
Fm3m
|
Рт3т
|
Fт3т
|
Рт3т
|
Fт3т
|
|
|
Т. пл., °С
|
703
|
58в
|
177в
|
180
|
470в
|
646
|
_
|
637
|
_
|
632
|
|
|
Т. кип., °С
|
1253
|
_
|
_
|
_
|
_
|
1295
|
_
|
1297
|
_
|
1280
|
|
|
Плотн. (25 °С),
г/см3
|
3,59г
|
3,68
|
3,81
|
_
|
3.983
|
_
|
4,43
|
_
|
4,509
|
_
|
|
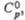
Дж/(моль х К) |
51,09
|
87,34
|
|
—
|
52,47
|
—
|
52,93
|
—
|
52,47
|
—
|
|
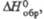
кДж/моль |
-557,1
|
-923 ,2
|
4,15д
|
—
|
-442,3
|
2,93д
|
-405,6
|
—
|
-348,1
|
—
|
|
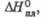
кДж/моль |
21,7
|
2,43д
|
—
|
2,76
|
—
|
20,38
|
—
|
23,6
|
—
|
25,65
|
|
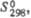
Дж/(моль х К) |
92,96
|
135,3
|
—
|
—
|
101,17
|
—
|
112,94
|
—
|
122,20
|
—
|
|
Показатель преломления
при 20 °С( 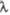 589
нм) |
1,480
|
—
|
—
|
—
|
1,6397
|
—
|
1,6984
|
—
|
1,7876
|
—
|
|
а Гранецентрир., при
высоких давлениях существует объемноцентрир. кубич. модификация. б
с = 0,784 нм. вТ-ра полиморфного перехода. г
При 20 оС.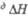 полиморфного перехода.
полиморфного перехода.
Ц. открыли Р. Бунзен и Г. Кирхгоф в 1861;
впервые выделил металлич. Ц. в 1882 К. Сеттерберг.
Лит.: Плющев В. Е., Степин Б. Д.,
Химия и технология соединений лития, рубидия и цезия, М., 1970; Коган Б.И.,
Названова В. А., Солодов Н.А., Рубидий и цезий, М., 1971; Плющев В. Е.,
Степин Б.Д., Аналитическая химия рубидия и цезия, М., 1975; Мозговой А.
Г. [и др.], в кн.: Обзоры по теплофизическим свойствам веществ, М., 1985,
№ 1, с. 3-108; Степин Б. Д., Цветков А.А., Неорганическая химия, М., 1994;
Hart W. А. [а. о.], The chemistry of lithium, sodium, potssium, rubidium,
cesium and francium, Oxf., 1975.
Л. И. Покровская.



 Cs+
Cs+ Cs2+
соотв. 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность
по Полингу 0,7; работа выхода электрона 1,81 эВ; металлич. радиус 0,266
нм, кова-лентный радиус 0,235 нм, ионный радиус Cs+ 0,181 нм
(координац. число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202
нм (12).
Cs2+
соотв. 3,89397, 25,1 эВ; сродство к электрону 0,47 эВ; электроотрицательность
по Полингу 0,7; работа выхода электрона 1,81 эВ; металлич. радиус 0,266
нм, кова-лентный радиус 0,235 нм, ионный радиус Cs+ 0,181 нм
(координац. число 6), 0,188 нм (8), 0,192 нм (9), 0,195 нм (10), 0,202
нм (12).
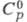 32,21 Дж/(моль x К);
32,21 Дж/(моль x К);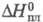 2,096 кДж/моль,
2,096 кДж/моль,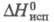 65,62 кДж/моль,
65,62 кДж/моль, 76,54 кДж/моль (298,15 К);
76,54 кДж/моль (298,15 К);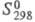 85,23 Дж/(моль x К); ур-ния температурной зависимости давления пара: lgp
(мм рт. ст.) = -4122/T+ 5,228 - 1,514 lgT + 3977T
(100-301,59 К), lgp (мм рт. ст.)= -3822/T + 4,940 - 0,746
lgТ (301,59-897 К); теплопроводность, Вт/(м x К): 19,0 (298 К),
19,3 (373 К), 20,2 (473 К);
85,23 Дж/(моль x К); ур-ния температурной зависимости давления пара: lgp
(мм рт. ст.) = -4122/T+ 5,228 - 1,514 lgT + 3977T
(100-301,59 К), lgp (мм рт. ст.)= -3822/T + 4,940 - 0,746
lgТ (301,59-897 К); теплопроводность, Вт/(м x К): 19,0 (298 К),
19,3 (373 К), 20,2 (473 К);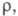 мкОм x м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59
К, жидкость), температурный коэф.
мкОм x м: 0,1830 (273,15 К), 0,2142 (301,59 К, твердый), 0,3568 (301,59
К, жидкость), температурный коэф.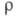 6,0 x 10-3 К-1 (273-291 К); парамагнетик, уд. магн.
восприимчивость +0,22 x 10-9 (293 К);
6,0 x 10-3 К-1 (273-291 К); парамагнетик, уд. магн.
восприимчивость +0,22 x 10-9 (293 К);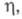 мПа x с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К);
мПа x с: 6,76 (301,59 К), 5,27 (350 К), 3,18 (500 К);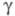 60,6 мН/м (301,59 К); температурный коэф. линейного расширения 97 x 10-6
К-1 (273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа
(293 К); коэф. сжимаемости 71 x 10-11Па-1 (323 К).
60,6 мН/м (301,59 К); температурный коэф. линейного расширения 97 x 10-6
К-1 (273 К); твердость по Моосу 0,2; модуль упругости 1,7 ГПа
(293 К); коэф. сжимаемости 71 x 10-11Па-1 (323 К).
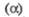
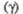
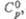 Дж/(моль x К)
Дж/(моль x К)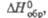 кДж/моль
кДж/моль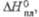 кДж/моль
кДж/моль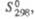 Дж/(моль К)
Дж/(моль К)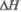 полиморфного перехода.
полиморфного перехода.
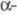 метилбензил)фенол,
алкилфенолы С7-С9 и др.]. Для получения соед. Ц.
высокой чистоты применяют его полигалогениды.
метилбензил)фенол,
алкилфенолы С7-С9 и др.]. Для получения соед. Ц.
высокой чистоты применяют его полигалогениды.
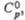 Дж/(моль х К)
Дж/(моль х К)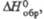 кДж/моль
кДж/моль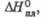 кДж/моль
кДж/моль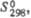 Дж/(моль х К)
Дж/(моль х К)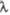 589
нм)
589
нм)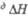 полиморфного перехода.
полиморфного перехода.