ЦЕЛЛЮЛАЗЫ
(целлюлолитич. ферменты),
ферменты класса гидролаз, катализирующие гидролиз 1,4-гликозидных связей
в молекуле целлюлозы с образованием набора олигосахаридов разл. степени
полимеризации вплоть до мономера -глюкозы.
Различают два осн. типа Ц.: эндоглюканазы
(1,4-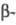 глюкан-4-глюканогидролазы,
эндо-1,4-
глюкан-4-глюканогидролазы,
эндо-1,4-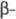 глюканазы)
и целлобиогидролазы (1,4-
глюканазы)
и целлобиогидролазы (1,4-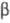 -D-глюкан-4-целлобиогидролазы,
экзоцеллобиогидролазы), отличающиеся по характеру действия на молекулы
целлюлозы и, как правило, действующие совместно.
-D-глюкан-4-целлобиогидролазы,
экзоцеллобиогидролазы), отличающиеся по характеру действия на молекулы
целлюлозы и, как правило, действующие совместно.
Ц. первого типа гидролизуют связи в молекуле
целлюлозы и нек-рых ее растворимых производных (карбоксиметил-, гидроксиэтилцеллюлоза
и др.) неупорядоченным способом, образуя набор поли- и олигомерных фрагментов
разл. длины. Катализируют также р-цию трансгликозилирования (присоединение
части расщепляемой молекулы поли- или олигосахарида к концевому невосстанавливающему
ангидроглюкозному остатку др. поли- или олигомерной молекулы субстрата).
Ц. второго типа гидролизуют молекулы целлюлозы,
образуя почти исключительно целлобиозу, к-рую они отщепляют с невосстанавливающего
конца полисахарида (п - число звеньев цепи):
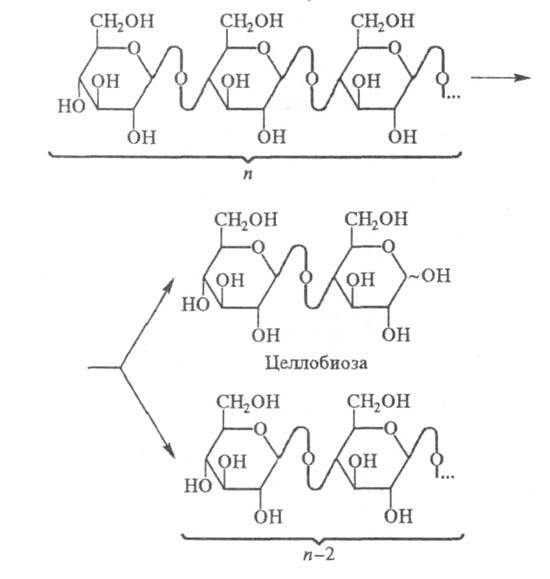
Другое отличие Ц. второго типа от эндоглюканаз
- незначит. снижение ими вязкости р-ров карбоксиметил- или гидроксиэтилцеллюлозы
(при равной степени гидролиза полимера).
Характерное св-во двух типов Ц.- наличие
синергизма (взаимного усиления) при их совместном действии на высокоупорядоченные
формы целлюлозы (хлопковое волокно, микрокристаллич. целлюлоза).
Ц. обнаружены у бактерий, актиномицетов,
грибов, растений. Наличие Ц. у животных однозначно не доказано, однако
мн. насекомые, птицы, жвачные, грызуны содержат в пищеварит. органах микрофлору,
образующую Ц. Способность жвачных животных переваривать клетчатку обусловлена
присутствием в их желудке (гл. обр. в рубце) симбиотич. анаэробных микроорганизмов,
выделяющих Ц.
Наиб. эффективные продуценты Ц. - грибы.
Ферментные системы грибов содержат, как правило, множественные формы обеих
форм Ц., отличающиеся мол. массой, изоэлектрич. точкой и содержанием ковалентно
связанных углеводных остатков. Часть Ц.- истинные изоферменты, кодируемые
самостоят. генами, др. формы образуются при посттрансляционной модификации
основных типов Ц.
Наиб. изученным продуцентом Ц., имеющим
важное прикладное значение, является почвенный грибок Trichoderma viride
(reesei). Он секретирует по меньшей мере 2 изофермента целлобиогидролазы
с мол. м. 65 и 55 тыс., рI 3,9-4,2 и 5,9-6,5 соотв., а также 2 изофермента
эндоглюканазы с рI 4,7 и 5,4. Определена первичная структура всех
этих ферментов. Оптимальное каталитич. действие Ц. большинства грибов проявляется
при рН 4-5.
Среди анаэробных бактерий наиб. известный
продуцент Ц. - Clostridium thennocellum. Структура Ц. этих бактерий существенно
отличается от Ц. грибов. Этот микроорганизм секретирует крупные
надмол. образования, в составе к-рых обнаруживается не менее 14 разл. белков,
в т. ч. молекулы Ц., - т. наз. целлюлосомы (общая мол. м. более 2 млн.).
Сходные образования обнаруживаются и у нек-рых др. анаэробных бактерий,
в т. ч. находящихся в желудке жвачных животных.
В составе целлюлосом обнаружены по крайней
мере 4 изофермента Ц. первого типа и 1 - второго. Для всех эндоглюканаз
целлюлосомы определена первичная структура, а для одной из них - также
пространственная. Оптимальная каталитич. активность бактериальных ферментов
при рН ок. 7.
Наиб. известный ингибитор Ц., в особенности
для Ц. второго типа,- целлобиоза.
В первичную структуру многих Ц. входит
т. наз. сорбционный домен - фрагмент полипептидной цепи, определяющий связывание
молекулы фермента с поверхностью целлюлозы. У разл. Ц. он локализован на
С- или на N-конце молекулы и связан переходной областью с каталитич. доменом.
Последний, при протеолитич. отщеплении сорбционного домена, способен катализировать
гидролиз производных целлюлозы в р-ре, но не активен по отношению к нерастворимым
субстратам.
Ц. применяют в произ-ве соков и вин (для
их осветления), комбикормов (для их лучшего усвоения), а также для получения
высококачественной бумаги.
Мировое произ-во Ц. составляет тысячи
тонн (в числе осн. производителей - Япония, Дания, Финляндия, Россия).
Лит.: Рабинович М. Л. [и др.], в
сб.: Итоги науки и техники, сер. Биотехнологи, т. 11, М., 1988, с. 4-149;
Biochemistry and genetics of cellulose degradation, eds. J. P. Aubert,
P. Beguin, J. Millet, L., 1988.
М. Л. Рабинович.
|

